金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
(本文是我在学习免疫的时候整理的知识点,摘自各个网站,具体是哪个已经忘记了,如有侵权请联系我删或者注明出处)
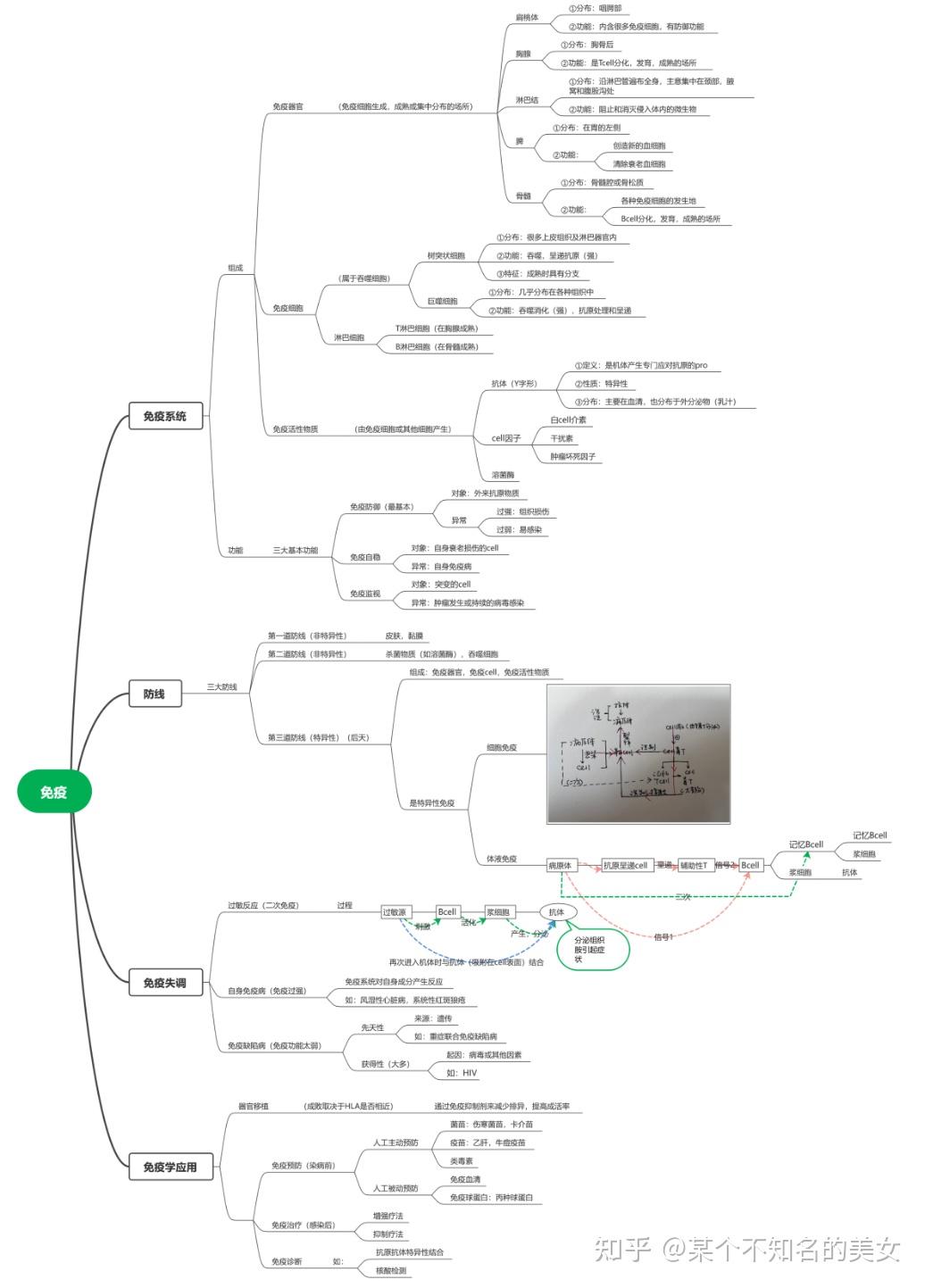
1. 基础知识
免疫是指机体免疫系统识别自身与异己物质,并通过免疫应答排除抗原性异物,以维持机体生理平衡的功能。
1.1 基本功能
免疫系统(Immune System)具有免疫监视、防御、调控的作用,由免疫器官(骨髓、脾脏、淋巴结、扁桃体、小肠集合淋巴结、阑尾、胸腺等)、免疫细胞(淋巴细胞、单核吞噬细胞、中性粒细胞、嗜碱粒细胞、嗜酸粒细胞、肥大细胞、血小板),以及免疫分子(抗体、溶菌酶、补体、免疫球蛋白、干扰素、白细胞介素、肿瘤坏死因子等细胞因子)组成。免疫系统分为固有免疫(又称非特异性免疫)和适应免疫(又称特异性免疫),其中适应免疫又分为体液免疫和细胞免疫。
免疫系统是机体执行免疫应答及免疫功能的重要系统,具有识别和排除抗原性异物、与机体其他系统相互协调,共同维持机体内环境稳定和生理平衡的功能。免疫系统是防卫病原体入侵最有效的武器,它能发现并清除异物、外来病原微生物等引起内环境波动的因素,但其功能的亢进会对自身器官或组织产生伤害。
免疫监视:识别和清除体内发生突变的肿瘤细胞、衰老细胞、死亡细胞或其他有害的成分,这种随时发现和清除体内出现的“非己”成分的功能被称之为免疫监视。
免疫防御:识别和清除外来入侵的抗原,如病原微生物等。这种防止外界病原体入侵和清除已入侵病原体及其他有害物质的功能被称之为免疫防御,使人体免于病毒、细菌、污染物质及疾病的攻击。
免疫调控:通过自身免疫耐受和免疫调节使免疫系统内环境保持稳定,修补免疫细胞能修补受损的器官和组织,使其恢复原来的功能。
1.2 人体防线
人体共有三道防线:
第一道防线,是由皮肤和黏膜构成的,他们不仅能够阻挡病原体侵入人体,而且它们的分泌物(如乳酸、脂肪酸、胃酸和酶等)还有杀菌的作用,呼吸道黏膜上有纤毛,可以清除异物。
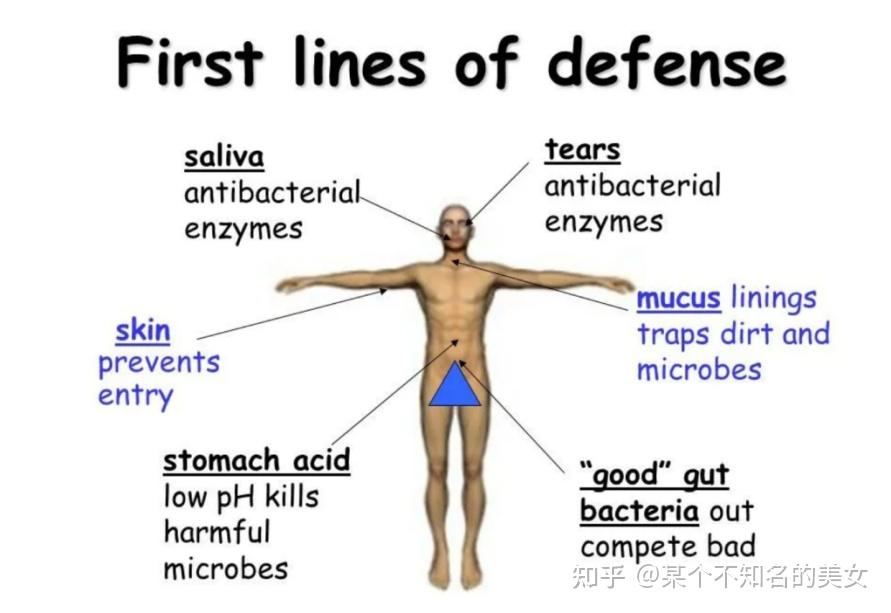
人体第一道防线
第二道防线是体液中的杀菌物质和吞噬细胞。一、二两道防线是人类在进化过程中逐渐建立起来的天然防御功能,特点是人人生来就有,不针对某一种特定的病原体,对多种病原体都有防御作用,多数情况下,这两道防线可以防止病原体对机体的侵袭。
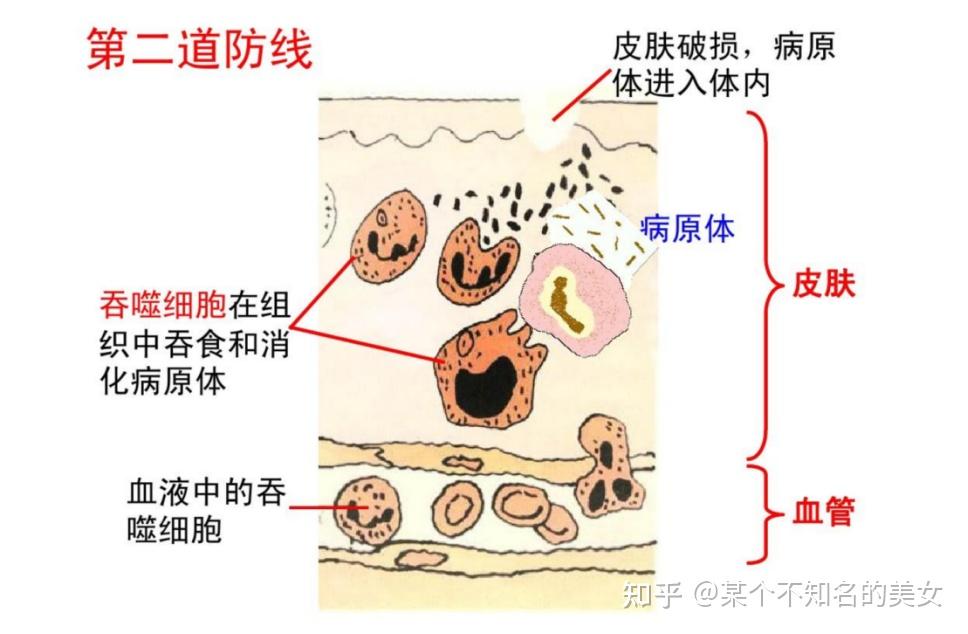
人体第二道防线
第三道防线,主要由免疫器官(胸腺、淋巴结和脾脏等)和免疫细胞(淋巴细胞)组成。第三道防线是人体在出生以后逐渐建立起来的后天防御功能,特点是出生后才产生的,只针对某一特定的病原体或异物起作用。
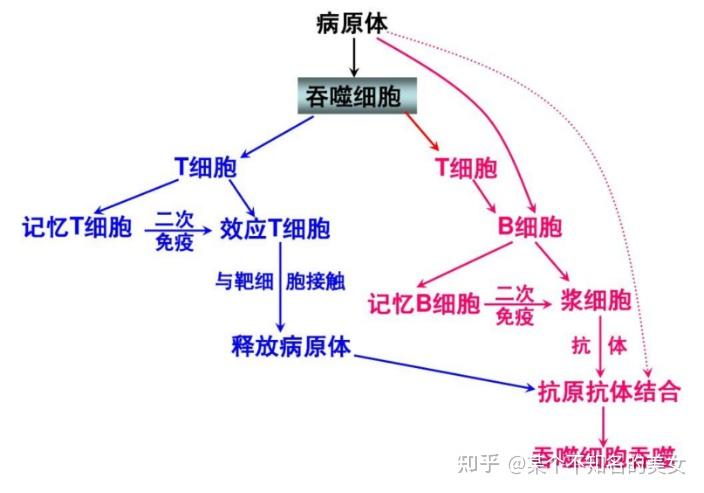
人体第三道防线示意图
1.3 免疫器官
免疫器官根据分化的早晚和功能不同,可分为中枢免疫器官(Central Immune Organ)和外周免疫器官(Peripheral Immune Organs),中枢免疫器官是免疫细胞发生、分化、成熟的场所;外周免疫器官是T、B淋巴细胞定居、增殖的场所及发生免疫应答的主要部位。
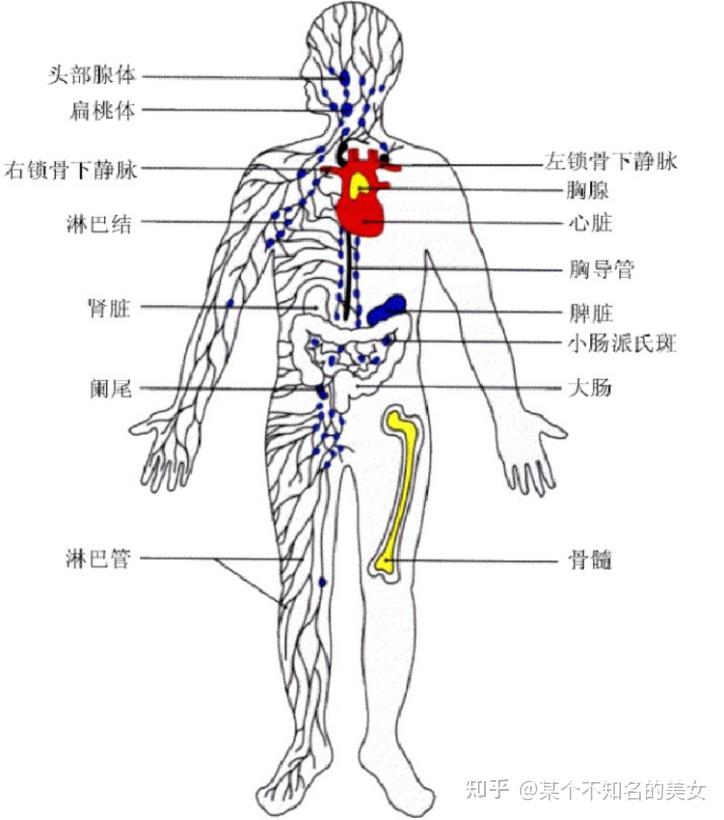
免疫器官和组织
1.3.1 中枢免疫器官
1.3.1.1 骨髓
骨髓(Bone Marrow, BM)是人和其他哺乳动物主要的造血器官,主要由造血干细胞、血细胞的前体细胞、网织红细胞以及大量的脂肪组织组成,是各种血细胞的重要发源地。骨髓含有强大分化潜力的多能干细胞,它们可在某些因素作用下分化为不同的造血祖细胞,进而分化为形态和功能不同的髓系干细胞和淋巴系干细胞。淋巴系干细胞再通过胸腺、腔上囊或类腔上囊器官(骨髓),分别衍化成T细胞和B细胞,最后定居于外周免疫器官。哺乳动物和人的B细胞在骨髓微环境和激素样物质作用下发育为成熟的B细胞。
骨髓的功能主要有以下3种:
(1)各类造血细胞和免疫细胞的发源地,如多能造血干细胞(multiple hematopoietic stem cells,HSC);
(2)B细胞分化成熟的场所;
(3)发生体液免疫应答的场所,也是发生再次体液免疫应答的主要部位。
1.3.1.2 胸腺
胸腺(Thymus)由突起连接成网状的胸腺基质细胞(胸腺上皮细胞、树突状细胞、Mφ、成纤维细胞)、细胞外基质、局部活性物质构成。胸腺皮质区密布了不成熟的胸腺细胞,它们逐渐向髓质区迁移,经过双阴性细胞、双阳性细胞,最终发育为成熟的单阳性胸腺细胞——T细胞。在这过程中,遍布于皮质、皮髓质交界处及髓质区的巨噬细胞(Mφ)、胸腺树突细胞在胸腺细胞表面主要组织相容性复合体(Major Histocompatibility Complex,MHC)阳性选择和阴性选择中起了相当重要的作用。人胸腺的大小和结构随年龄的不同具有明显的差异,胸腺于胚胎20周发育成熟,是发生最早的免疫器官,到出生时胸腺约重15~20 g,以后逐渐增大,至青春期可达30~40 g,青春期后,胸腺随年龄增长而逐渐萎缩退化,到老年时基本被脂肪组织所取代,随着胸腺的逐渐萎缩,功能衰退,细胞免疫力下降,对感染和肿瘤的监视功能减低。
胸腺有胸腺皮质(Cortex)和胸腺髓质(Aedulla)。皮质主要由淋巴细胞和上皮性网状细胞构成,上皮性网状细胞呈星状,相邻细胞的胞突彼此接触,并以桥粒相连接,形成细胞网,其胞核较大,呈卵圆形,含1~2个核仁,胞质中有成束的纤维细丝、颗粒及泡状结构。网状细胞之间充满密集的淋巴细胞,胸腺的淋巴细胞又称胸腺细胞,它们在皮质内的分布很密,并有一定的排列规律,靠近皮质最浅层的细胞较大,胞核直径约为9 um,占胞体大部分,富于常染色质,核仁明显,胞质嗜碱性强,含有丰富的多聚核蛋白体,为较原始的淋巴细胞。皮质中层为中等大小的淋巴细胞,皮质深层为小淋巴细胞,从浅层到深层是造血干细胞增殖分化为T淋巴细胞的过程。另外,皮质中还有巨噬细胞,其胞质中常含有吞噬颗粒。胸腺髓质中淋巴细胞少,多为小淋巴细胞,上皮性网状细胞较多而显著,形态多种多样,有星形、圆形及扁平状等,细胞间由桥粒连接,胞质中有颗粒和泡状物质。胸腺髓质内有散在的胸腺小体,多呈圆形,大小不等,由胸腺上皮细胞呈同心圆状包绕排列而成,其外层细胞胞核明显,呈新月状,近小体中心的上皮细胞胞质呈嗜酸性,胸腺小体的功能尚不明确。
胸腺具有以下3种功能:
(1)T细胞分化、成熟的场所(90%以上的胸腺细胞凋亡,约5%分化为成熟的T细胞);
(2)免疫调节:对外周免疫器官和免疫细胞具有调节作用;
(3)自身免疫耐受的建立与维持。
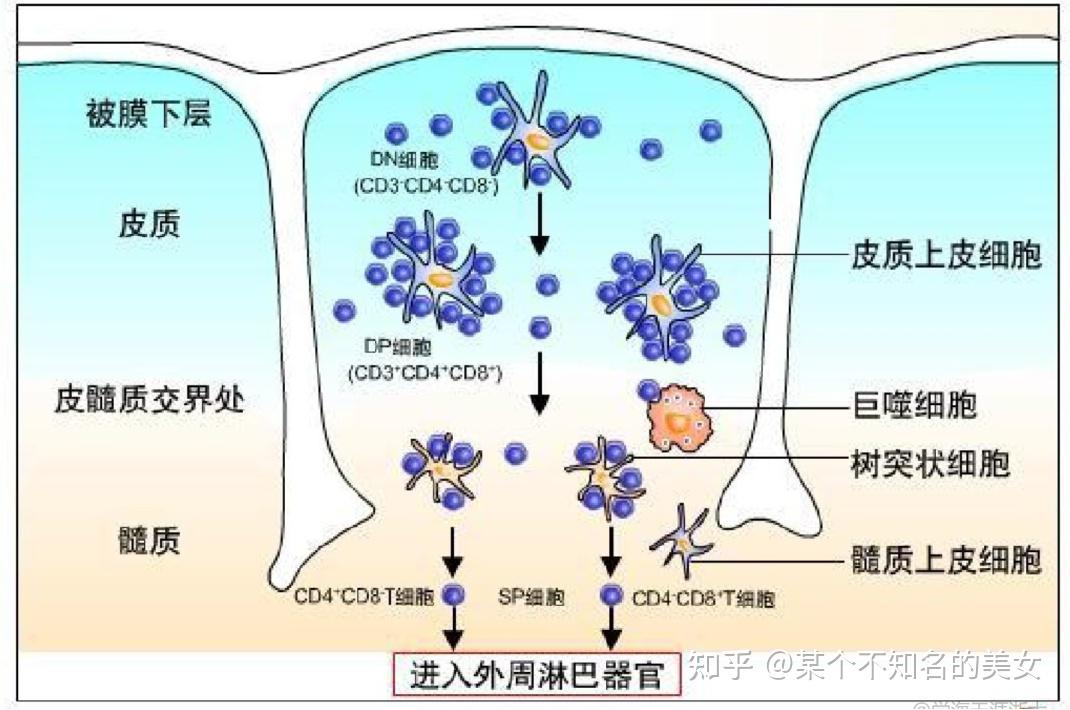
胸腺微环境与T细胞分化图
1.3.1.3 法氏囊
法氏囊(Bursa of Fabricius)是鸟类体液免疫系统B淋巴细胞分化成熟的中枢器官,位于泄殖腔背侧的囊状结构,是鸟类特有的结构。
1.3.2 外周免疫器官
外周免疫器官又称二级免疫器官,是成熟淋巴细胞定居的场所,也是这些细胞在外来抗原刺激下产生免疫应答的主要部位。外周免疫器官包括淋巴结(Lymph Node)、脾脏(Spleen)、黏膜相关淋巴组织(Mucosal Associated Lymphoid Tissue,MALT)、皮肤相关淋巴组织(Skin Associated Lymphoid Tissue,SALT)。
1.3.2.1 淋巴结
淋巴结内T细胞约占75%,B细胞占25%。淋巴结包括皮质区(浅皮质区、深皮质区)和髓质区。浅皮质区一般分布在近被膜下,B细胞定居的场所,称为非胸腺依赖区,大量B细胞聚集形成淋巴滤泡或称淋巴小结。浅皮质区与髓质之间的深皮质区是副皮质区,是T细胞定居的场所,称为胸腺依赖区,髓质区有髓索和髓窦组成,聚集B细胞和浆细胞。
淋巴结具有以下功能:
(1)T细胞和B细胞定居的场所;
(2)免疫应答发生的场所;
(3)参与淋巴细胞再循环;
(4)对侵入机体的病原体等有害物质有过滤作用。
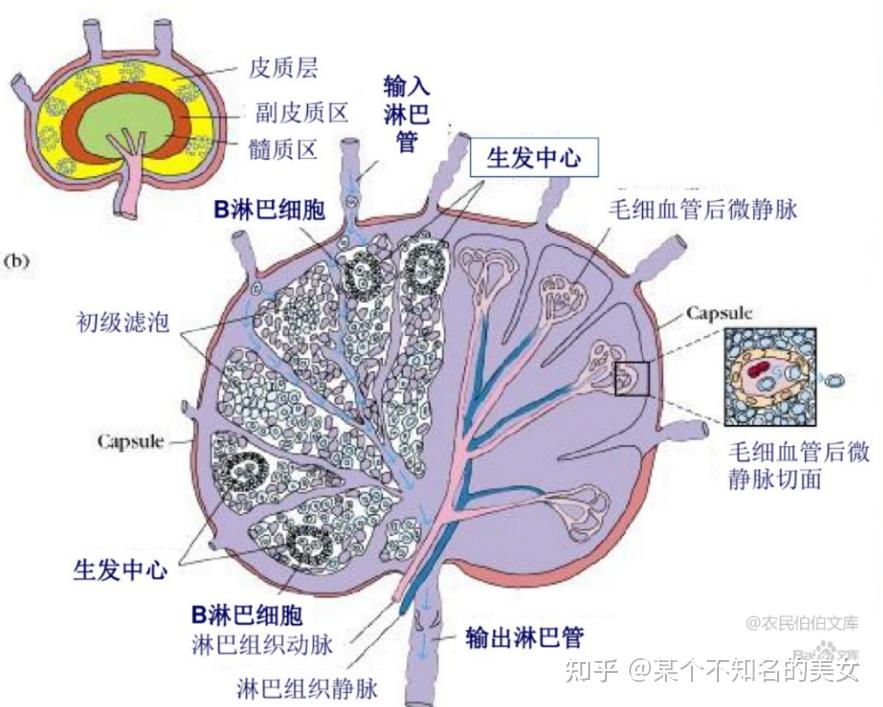
淋巴结的结构
1.3.2.2 脾脏
脾外层为结缔组织被膜,被膜向脾内伸展形成若干小梁。脾实质可分为白髓和红髓,白髓为密集的淋巴组织,由围绕中央动脉而分布的动脉周围淋巴鞘、淋巴滤泡和边缘区组成,红髓分布于被膜下、小梁周围及白髓边缘区外侧的广大区域,由脾索和脾血窦组成。
脾脏是血液的仓库,它承担着过滤血液的职能,除去死亡的血球细胞,并吞噬病毒和细菌,激活B细胞使其产生大量的抗体。脾是胚胎时期的造血器官,自骨髓开始造血后,脾演变为人体最大的外周免疫器官。
脾具有4种功能:
(1)T细胞和B细胞的定居场所;
(2)免疫应答发生的场所;
(3)合成某些生物活性物质;
(4)对侵入机体的病原体等有害物质有过滤作用。
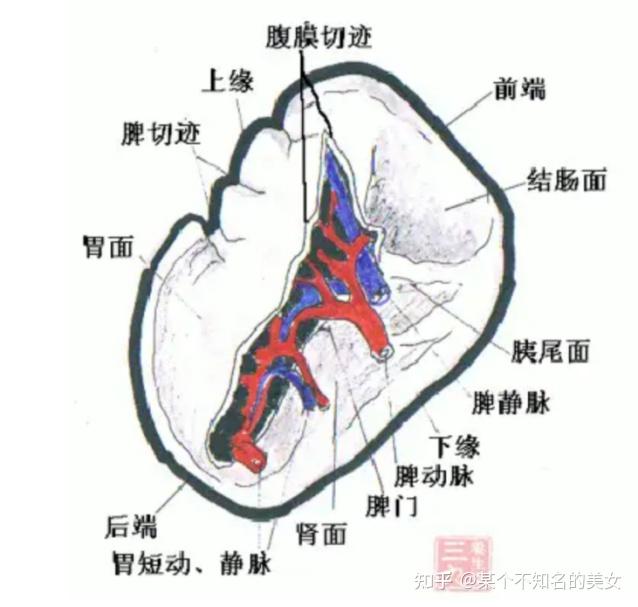
脾脏结构图
1.3.2.3 黏膜相关淋巴组织
黏膜相关淋巴组织,也称黏膜免疫系统(Mucosal Immune System,MIS),包括消化道,呼吸道和泌尿生殖道等黏膜部位的淋巴组织,包括具有一定结构的黏膜淋巴滤泡,如小肠的派氏集合淋巴结(Peyer's Patches,PP)、扁桃体、阑尾等,以及弥散的黏膜淋巴组织。
1.3.2.4 皮肤相关淋巴组织
皮肤相关淋巴组织,也称皮肤免疫系统(Cutaneous Immune System,CIS),主要由分散于皮肤内的免疫细胞组成。
1.4 免疫细胞
1.4.1 固有免疫细胞
1.4.1.1 吞噬细胞
通常将体内具有吞噬功能的一群细胞称为吞噬细胞,主要包括单核吞噬细胞系统和中性粒细胞。单核吞噬细胞系统( Mononuclear Phagocyte System,MPS)包括游离于血液中的单核细胞(Monocyte)及进入各种组织后发育而成的巨噬细胞(Macrophage)。巨噬细胞具有很强的吞噬能力,还是一类主要的抗原递呈细胞,在特异性免疫应答的诱导与调节中起关键作用。中性粒细胞是一类小吞噬细胞,具有非特异性免疫防御作用并参与机体的免疫应答、炎症损伤等。吞噬作用是指细胞将颗粒物内化为细胞质小泡,通常在吞噬细胞识别到病原体时被触发。吞噬细胞中含有溶酶体,它是一种含有酶的颗粒,这些酶能与小泡融合并降解颗粒物。此外,一系列吞噬细胞酶的激活会导致有毒分子的产生,即氧化爆发,这是杀死和吞噬病原体的必要条件。因此,吞噬细胞主要负责清除微小的细胞外病原体,如细菌、原生动物、真菌和细胞碎片等。吞噬细胞第二个重要作用是可以产生细胞因子和细胞表面分子向适应性免疫系统传递感染的信号。
中性粒细胞来源于骨髓的造血干细胞,在骨髓中分化发育后,进入血液或组织。中性粒细胞约占外周血白细胞总数的50%~70%,胞浆内有许多弥散分布的细小的嗜中性颗粒,颗粒中含有髓过氧化物酶、酸性磷酸酶、防御素、溶菌酶等。中性粒细胞具有很强的趋化作用和吞噬功能,膜表面有IgG Fc受体和补体C3b受体,可加速吞噬作用,也可通过调理作用增强其吞噬作用。
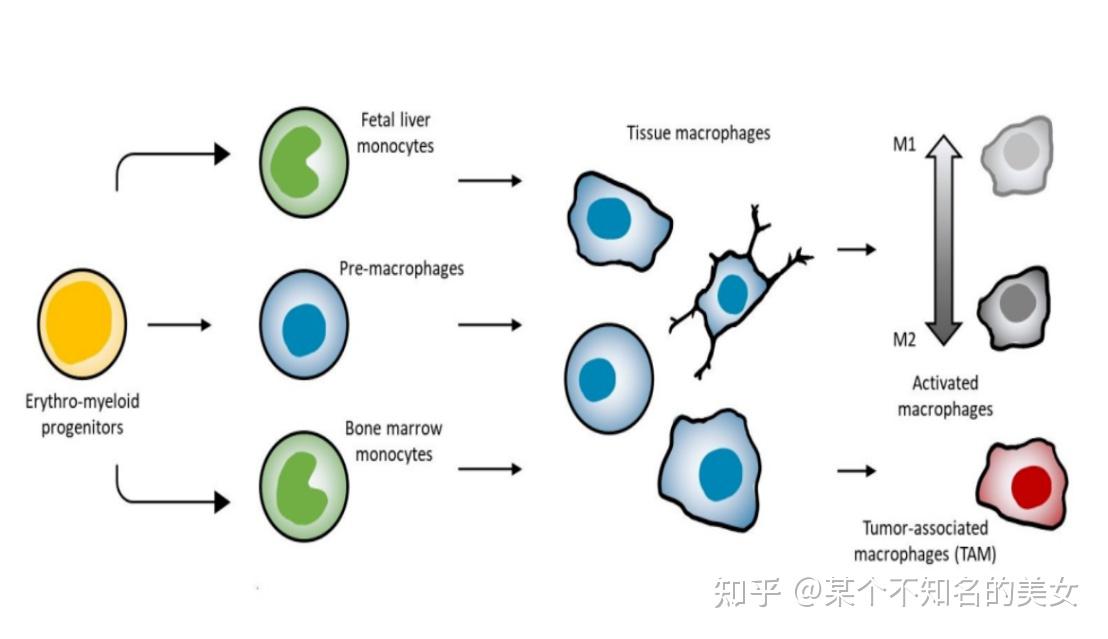
巨噬细胞分化图谱
(1)Ⅰ型巨噬细胞(Type-1 Macrophage,M1)又称经典活化的巨噬细胞,是在局部微环境中病原体及其产物与单核细胞表面TLR结合介导产生的信号刺激分化而成,其通过合成分析CCL2、CCL3/CXCL8等趋化因子和IL-1β、IL-6、TNF-α等促炎细胞因子介导产生炎症反应。
(2)Ⅱ型巨噬细胞(Type-II Macrophage,M2)是在局部微环境中IL-4、IL-12等Th2型细胞因子刺激诱导分化而成。可通过合成分泌IL-10、TGF-β、血小板衍生生长因子和FGF,介导产生抑炎作用和参与损伤组织的纤维化和修复。
1.4.1.2 树突细胞
树突状细胞(Dendritic Cell,DC)是一类成熟时具有许多树突样突起的、能够识别、摄取和加工外源性抗原并将抗原肽递呈给初始T细胞的专职性抗原递呈细胞(Antigen-presenting cell,APC),它来源于髓样干细胞(Myeloid Stem Cell)和淋巴样干细胞(Lymphoid Stem Cell)。DC是机体适应性免疫的始动者,也是连接固有免疫和适应性免疫的桥梁,DC主要分为经典DC(cinventional DC,cDC)及浆细胞样DC(plasmacytoid DC,pDC)两大类。
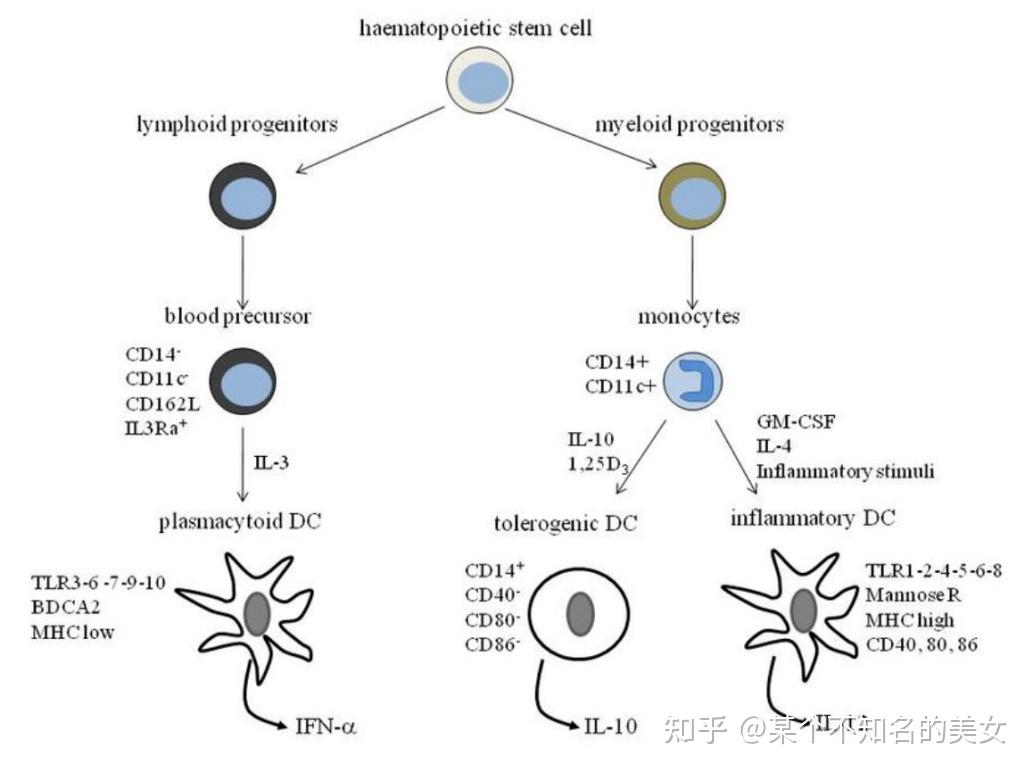
树突细胞分化图谱
1.4.1.3 NK T细胞
NK T细胞(Natural Killer T cell)是一种细胞表面既有T细胞受体TCR,又有NK细胞受体的特殊T细胞亚群,NK T细胞能大量产生细胞因子,且可以发挥与NK细胞相似的细胞毒作用。NK T细胞能表达T细胞的TCR与NK细胞的NKR-P1两种受体,特别是NK T细胞多数表达Va14TCR,识别CD1抗原,而NKR-P1识别各种糖链。NK T细胞,特别是CD4-NKT细胞,对TCR刺激可产生大量IL-4及IFNγ,同时具有ThO型细胞因子产生能力,NK T细胞不但是产生IL-4的主要细胞,而且强力产生IFNγ。IFNγ参与自身Th1诱导,具有强的Th1诱导能力,从而是IL-2产生亢进,它同时还具有Th2细胞分化抑制功能。IL-12能诱导NK T细胞产生IFNγ,IL-12对TCR的刺激是IFNγ的产生显著亢进。NK T细胞的活化通常伴有T细胞、B细胞及NK细胞的活化,这对NK T细胞活化后的免疫应答有较大影响。
NK T细胞其主要特征为:
(1)共表达T细胞受体和NK细胞受体。经典NK T细胞一般为CD4+和DN NKT细胞,其中NK1.1是NK T细胞最主要的表面标记;
(2)TCR基因偏向性取用(Bias Usage),与其它T细胞亚群相比,NK T细胞具有独特的限制性表达TCR库;
(3)接受CD1d递呈的脂类抗原,在固有免疫中发挥作用;
(4)NK T细胞表达的是“半恒定的”TCRαβ肽链,意思是指TCRα链相对恒定,而TCRβ链具有多样性,例如人NK T细胞的TCRα链均表达Vα14/Jα18;
(5)CD4和CD8的表达不均一,人NK T细胞可能为CD4+CD8-、CD4-CD8+或双阴性CD4-CD8-细胞。
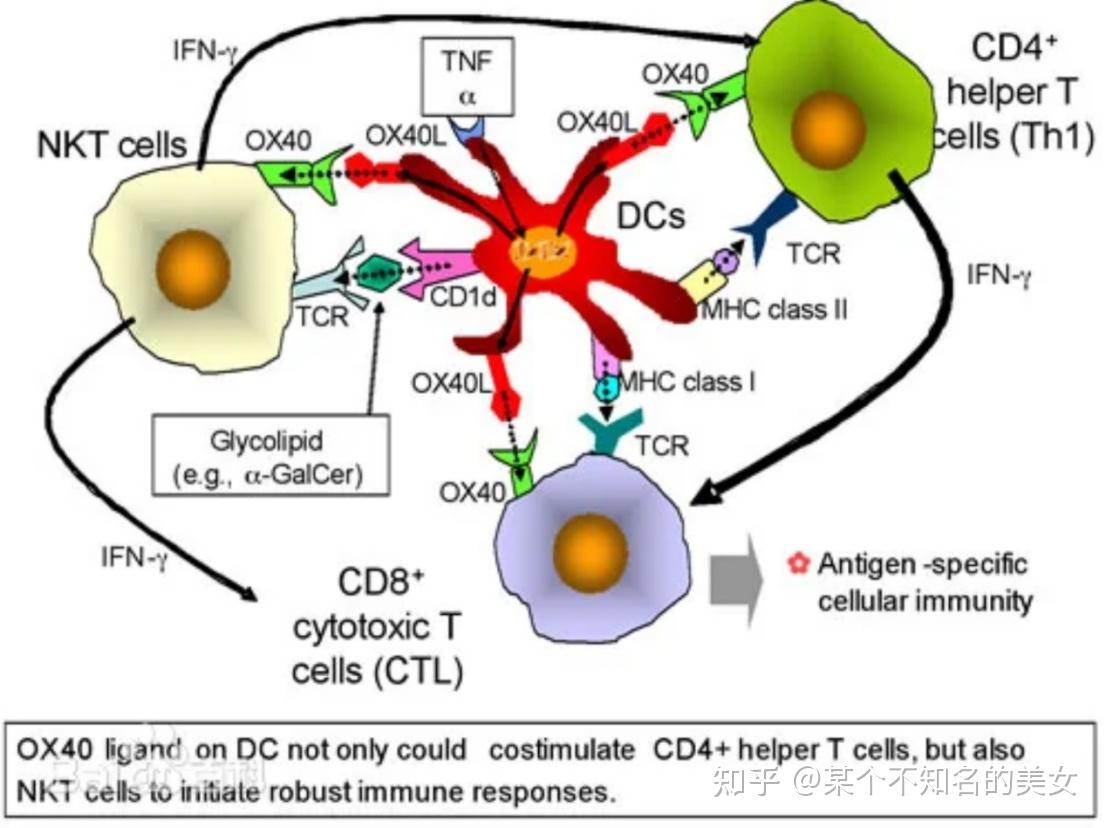
NK T细胞主要包括免疫调节和细胞毒作用,NK T细胞受到刺激后,可以分泌大量的IL-4、IFN-γ、GM-CSF、IL-13和其它细胞因子和趋化因子,发挥免疫调节作用,NK T细胞是联系固有免疫和获得性免疫的桥梁之一。NK T细胞活化后具有NK细胞样细胞毒活性,可溶解NK细胞敏感的靶细胞,主要效应分子为穿孔素,Fas配体以及IFN-γ。
通常认为,构成机体免疫系统的淋巴细胞有三种细胞系组成,一是由胸腺产生的T细胞,二是由骨髓分化而来的产生抗体的B细胞,三是自然杀伤细胞(NK细胞)。T细胞识别的抗原是蛋白质,而NK T细胞识别的抗原是α-Gal-Cer即所谓的糖脂质,这是该免疫系统与通常的免疫系统重要的不同点。NK T细胞的分化与T细胞不同的是在胸腺形成前的胎生初期6.5日在胸腺外组织分化。NK T细胞与T细胞比较,机能处于不发达状态。T细胞分化为功能不同的Th1和Th2细胞群,Th1细胞产生INFγ及IL-2,引起迟发行过敏症等细胞性炎症,Th2细胞能产生IL-4和IL-10,参与变态反应及抗体产生等体液免疫反应,而NK T细胞不但能分泌Th1和Th2细胞因子,同时还具有与CD8+杀伤性T细胞(Cytotoxic T Lymphocytes,CTL)相同的杀伤靶细胞作用。NK T细胞在免疫调节系统中占有重要位置,NK T细胞与疾病可能有诸多关系,可能与自身免疫性疾病的发病机制、变态反应的调节、抗肿瘤作用、及抑制寄生虫感染等有关。
1.4.1.4 NK细胞
自然杀伤细胞(Natural Killer cell,NK)是机体重要的免疫细胞,不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生,能够识别靶细胞、杀伤介质。NK细胞来源于骨髓淋巴样干细胞,其分化、发育依赖于骨髓及胸腺微环境,是一类无需预先致敏就能非特异性杀伤肿瘤细胞和病毒感染细胞的淋巴细胞,具有免疫清除和免疫监视的功能。NK细胞主要分布于外周血中淋巴结、脾脏和骨髓中,占外周血淋巴细胞的15%左右,常被定义为CD3‒CD56+细胞,它们被分为两个具有不同功能和成熟状态的主要亚群:CD56+CD16+和CD56+CD16+。大多数NK细胞CD56表达密度低、CD16表达水平高,可刺激DC成熟,并在单核细胞和细胞毒性T细胞的激活中发挥作用。根据表面CD56的数量,NK细胞可分为两种基础类型:高表达CD56(CD56hi)和低表达CD56(CD56lo)。CD56hi约占NK细胞总数的90%以上,其发挥的作用是抗体依赖细胞介导的细胞毒作用。根据与配体的结合方式可分为与活化配体结合的活化类受体和与主要组织相容复合体I(MHCI)类分子结合的抑制类受体,两种受体都可以和靶细胞表面的配体结合,抑制性受体传达抑制信号,从而使NK细胞对具备自身MHC分子的细胞反应钝化,这种方式可以避免自身正常细胞受到攻击。当机体对抗肿瘤细胞或病毒时,MHCI还可以使NK细胞表面的抑制作用减弱,间接加强了其对肿瘤细胞的杀伤。
NK细胞的作用主要有以下4个方面:
(1)免疫监视:NK免疫细胞能高度识别、监视体内细胞病变,防止超敏反应,执行免疫监视;
(2)清除病原体:NK免疫细胞会抵抗外来的细菌和病毒,清除潜伏病毒;
(3)抗衰老:免疫细胞可诱导老细胞凋亡,促进信息报产生,提升精力、体力、延缓衰老;
(4)杀伤肿瘤细胞:NK细胞是机体重要的免疫细胞,可靶向性杀伤肿瘤细胞,是未来治疗肿瘤的体细胞。
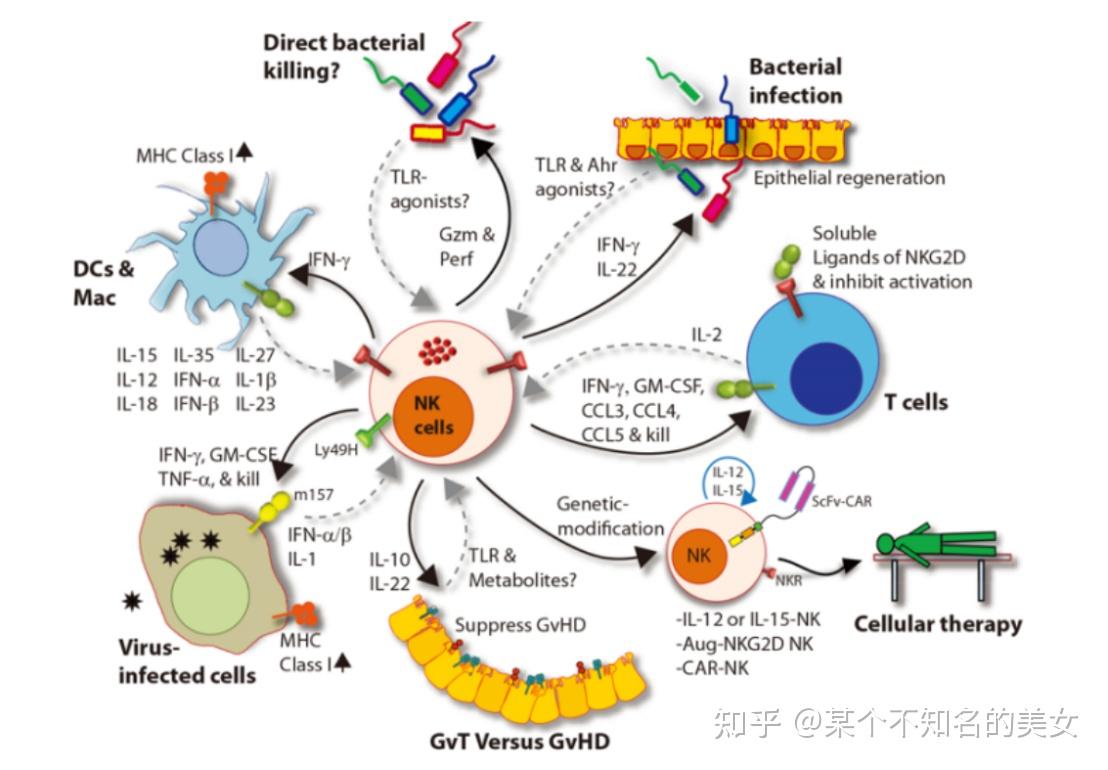
NK细胞分泌的细胞因子作用
1.4.1.5 其他细胞
粒细胞(Granulocyte),来源于骨髓中的粒细胞/巨噬细胞前体,主要分布于血液和黏膜结缔组织中,包含中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞三类,粒细胞是参与炎症或过敏性炎症反应的重要效应细胞。中性粒细胞(Neutrophi),约占外周血白细胞总数的60-70%,细胞表面具有受体CXCR1(IL-8R)和C5aR,可被IL-8和过敏性毒素C5a从血液中招募到感染炎症部位发挥作用。嗜酸性粒细胞(Eosinophil),约占外周血白细胞总数的5-6%,其表面具有趋化受体CCR3、PAF-R、IL-5R等多种与其趋化/活化相关的受体。嗜碱性粒细胞(basophil),占外周血白细胞总数的0.2%,其表面具有CCR3等趋化因子受体,可被CCL1等相关趋化因子从血液中招募到炎症或过敏性炎症反应部位发挥作用。
肥大细胞(Mast cell)。来源于外周血中的肥大细胞前体(Precursor of Mast cell),主要存在于黏膜和结缔组织中,其表面具有趋化性受体CCR3、过敏毒素受体(C3aR/C5aR)、Tol1样受体(TLR2/TLR4)和高亲和力IgE Fe受体,它主要作用是输送到被感染部位,分泌细胞因子参与和促进局部炎症反应。
固有免疫细胞主要是发挥非特异性抗感染效应,是机体在长期进化中形成的防御细胞,能对侵入的病原体迅速产生免疫应答,亦有清除体内损伤、衰老或畸变的细胞。
1.4.2 适应性免疫应答细胞
骨髓和胸腺是人体的中枢免疫器官,是免疫细胞发生、分化、发育和成熟的场所,其中骨髓是各类免疫细胞的发源地。骨髓中的造血干细胞(Hemetopoietic Stem Cell,HSC)是具有高度自我更新能力和分化潜能的干细胞,体内的血细胞均由造血干细胞分化而来。在骨髓造血微环境的诱导下,HSC最初分化成定向干细胞,包含髓样干细胞(Myeloid Stem Cell)和淋巴样干细胞(Ymphoid Stem Cell)。髓样干细胞进一步分化成巨核细胞(Megakaryocyte)、红细胞(Erytherocyte)、肥大细胞(Mast)、粒细胞(Maeloblast);淋巴干细胞可分化为NK细胞、祖B细胞和祖T细胞。其中NK细胞和B祖细胞在骨髓中继续分化成熟,T祖细胞则被转运到胸腺,在胸腺中分化成熟。
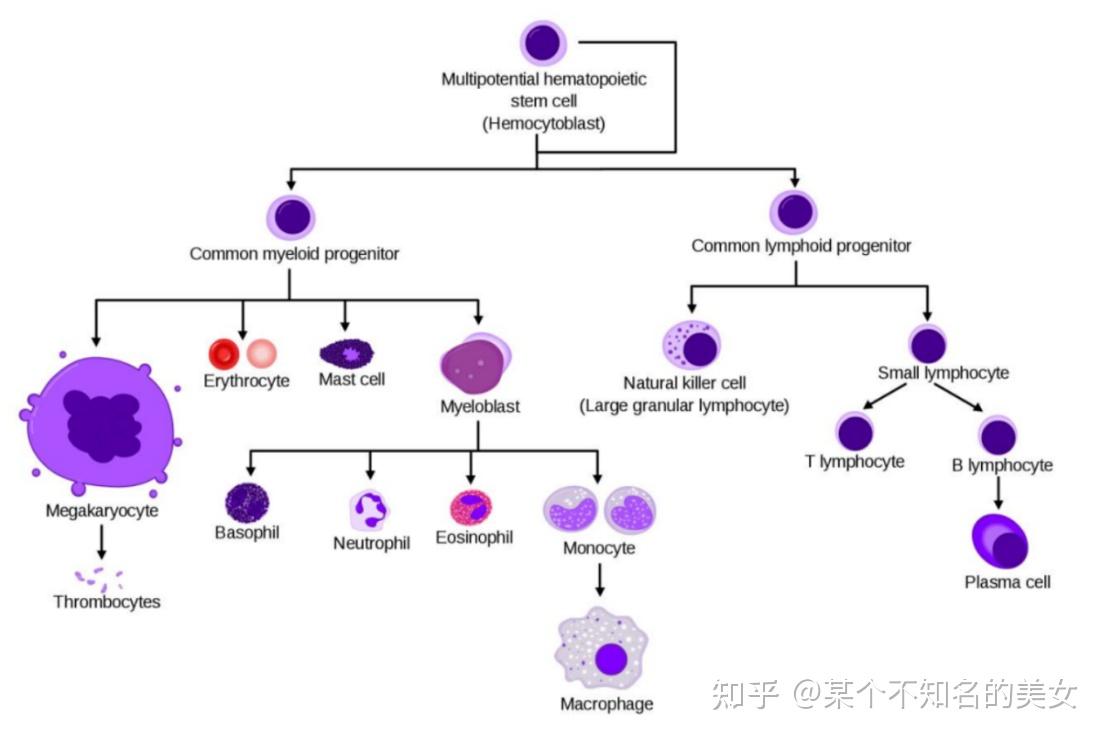
免疫细胞分化图谱
1.4.2.1 T淋巴细胞
淋巴样祖细胞随血液转运到胸腺之后,完成细胞的发育,成为成熟的细胞,因此这类细胞称为T淋巴细胞,T淋巴细胞是淋巴细胞的主要成分,在细胞免疫中扮演重要角色。T细胞成熟整个阶段分别为淋巴样祖细胞、T祖细胞(pro-T cell)、前T细胞(pre-T cell)、未成熟T细胞、成熟淋巴细胞。
依据CD4和CD8的表达可将胸腺中的T细胞又可分为双阴性细胞(Doublenegative Cell,DN细胞)、双阳性细胞(Double Positive Cell,DP细胞)和单阳性细胞(Single Positive Cell,SP细胞)三个阶段。pro-T重排TCR基因,在IL-7等细胞因子的诱导下,pre-T增值活跃,并表达CD4和CD8,细胞进入DP阶段。
DP的pre-T细胞停止增殖,开始重排α基因,并与β链组装成TCR(α:βTCR)。成功表达TCR的细胞即是未成熟的T细胞。SP细胞经历阳性和阴性选择后成为成熟的T细胞,通过血液循环进入到外周免疫器官。这个过程理解为,DP细胞表达的TCR和胸腺上皮细胞表面的MHC Ⅰ分子和MHC II相互作用,高亲和力的DP存活并获得MHC限制性,95%低亲和力的DP凋亡,与MHC Ⅰ结合的DP细胞CD8表达水平升高,CD4表达下调;与MHC II结合的DP细胞CD4表达升高,CD8表达下调。SP细胞再次与胸腺树突状细胞和巨噬细胞的MHC Ⅰ及MHC II相互作用,高亲和力的SP发生凋亡,少部分发育成调节性细胞(Treg),低亲和力的SP细胞则发育成成熟的T细胞进入到外周免疫器官。
T细胞成熟之后又可根据活化阶段可分为出初始T细胞(Naive T cell)、效应T细胞 (Effector T cell,Teff)和记忆T细胞(Memory T cell,Tm)。根据TCR类型分类可分为αβ T细胞和γσ T细胞,绝大部分的T细胞是αβ T细胞。根据是否表达CD4和CD8,则可将T细胞分为CD4+T和CD8+T,CD4+T主要辅助T细胞和调节T细胞,而CD8+T则更多是效应T细胞。
对于T细胞的分型则更多是根据功能特征进行划分:可分别分为辅助T细胞(Helper T cell,Th)、细胞毒性T细胞(Cytotoxic T Lymphocyte,CTL)、调节性T细胞(Regulatory Tcell,Treg)。
Th细胞均表达CD4,通常所称的CD4+T细胞即指的是辅助T细胞,未受抗原刺激的CD4T细胞为Th0,细胞内病原体和肿瘤抗原及IL-12、INF-V诱导Th0分化为Th1,普通细菌和可溶性抗原及IL-4诱导Th0分化为Th2,TGF-β和IL-4诱导Th0向Th9分化,Th0由TGF-β和IL-6分化为Th22,IL-21和IL-6诱导Th0分化为Tfh。
(1)Th1主要分泌Th1型细胞因子,包括IFN-γ、TNF-α、IL-2等,它主要的功能是通过分泌的细胞因子增强细胞介导的抗感染免疫,特别是抗胞内病原体的感染。
(2)Th2主要分泌Th2型细胞因子,包括IL-4、IL-5、IL-6、IL-10、IL-13等,他们能促进Th2细胞的增殖,进而辅助B细胞活化,发挥体液免疫的作用,同时抑制Th1的增殖。
(3)Th9通过分泌其特征性细胞因子IL-9在过敏性疾病、抗寄生虫感染和自身免疫性疾病中发挥重要作用。
(4)Th17通过分泌IL-17(包括IL-17A-F)、IL-21、IL-22、IL-26、TNF-α等多种细胞因子参与与固有免疫和某些炎症的发生。
(5)Th22是一群IL-17A、IL-22、IFN γ的Th,表达趋化因子受体CCR4、CCR6和CCR10,通过分泌IL-22/L-23和TNF-α参与上皮细胞的生理功能和炎症病理过程。
(6)Tfh滤泡辅助T细胞(Follicular Helper T cell,Tfh)是一种存在于外周免疫器官淋巴滤泡的CD4+T细胞,产生的IL-21在B细胞分化为浆细胞、产生抗体,是辅助B细胞应答的关键细胞。
细胞毒性T细胞(Cytotoxic T Lymphocyte,CTL)表达CD8,通常所称的CD8+T即是CTL。他的主要功能是特异性识别内源性抗原肽MHC Ⅰ类分子复合物,进而杀伤靶细胞。
调节性T细胞(Regulatory T cell,Treg),通常所称的Treg是指CD4+、CD25+、Foxp3+的T细胞。Foxp3+是Treg重要的分子标志,参与Treg的分化和功能。
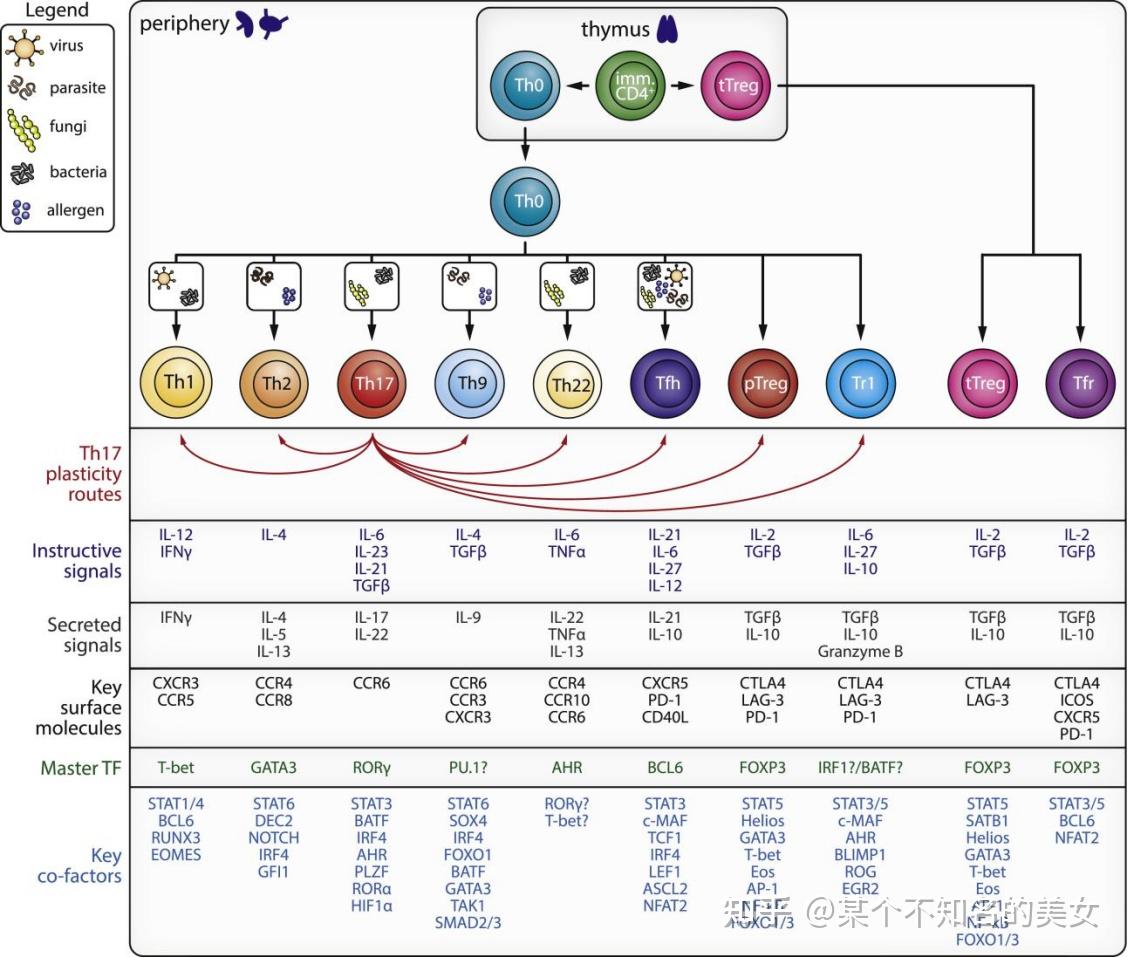
辅助T细胞分化图谱
1.4.2.2 B淋巴细胞
B淋巴细胞(B Lymohocyte)是由哺乳动物骨髓(Bone Marrow)或鸟类法氏囊(Burse of Fabricius)中的淋巴样干细胞分化发育而来,故称B细胞,是体液免疫的主要免疫细胞。B细胞在骨髓中的发育经历祖B细胞(pro-B cell)、前B细胞(pre-B cell)、未成熟B细胞(Immature B cell)和成熟B细胞等几个阶段。B细胞表面最重要的分子是BCR复合物,BCR复合物由识别和结合抗原的mlg和传递抗原刺激信号的Igα/lgβ(CD79a/CD79b)异二聚体组成,同时B细胞表面还有CD19与CD21及CD81非共价相连,形成B细胞的多分子共受体。根据B细胞所处的活化阶段,B细胞可分为初始B细胞、记忆B细胞和效应B细胞。
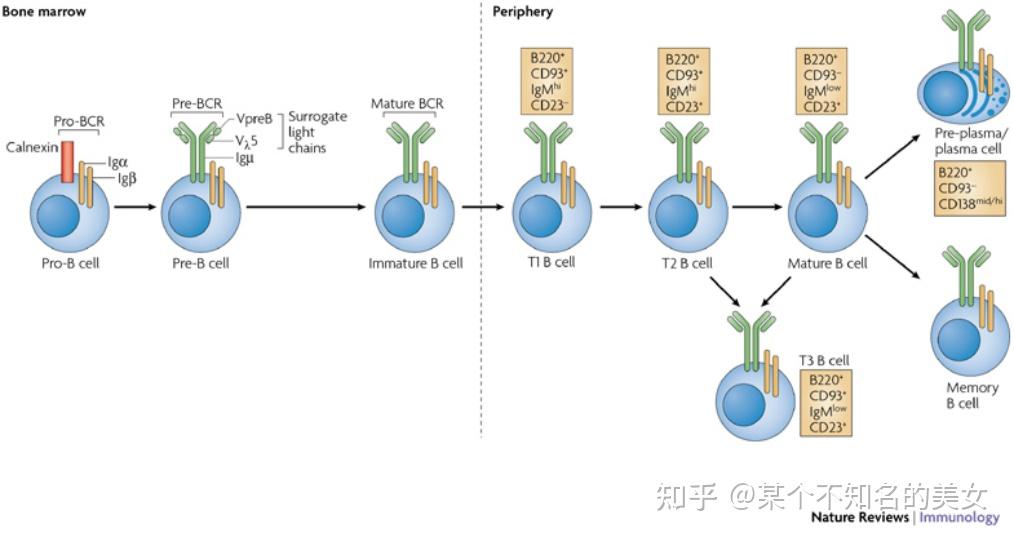
B细胞分化图谱
(1)初始B细胞是指从未接受过抗原刺激的B细胞,接受抗原刺激并活化后,分化成记忆B细胞或浆细胞;
(2)记忆B细胞接受抗原刺激以后在生发中心分化成为效应B细胞;
(3)效应B细胞又称浆细胞,是经由抗原激活的初始B细胞或记忆B细胞分化而来,是抗体的主要来源。
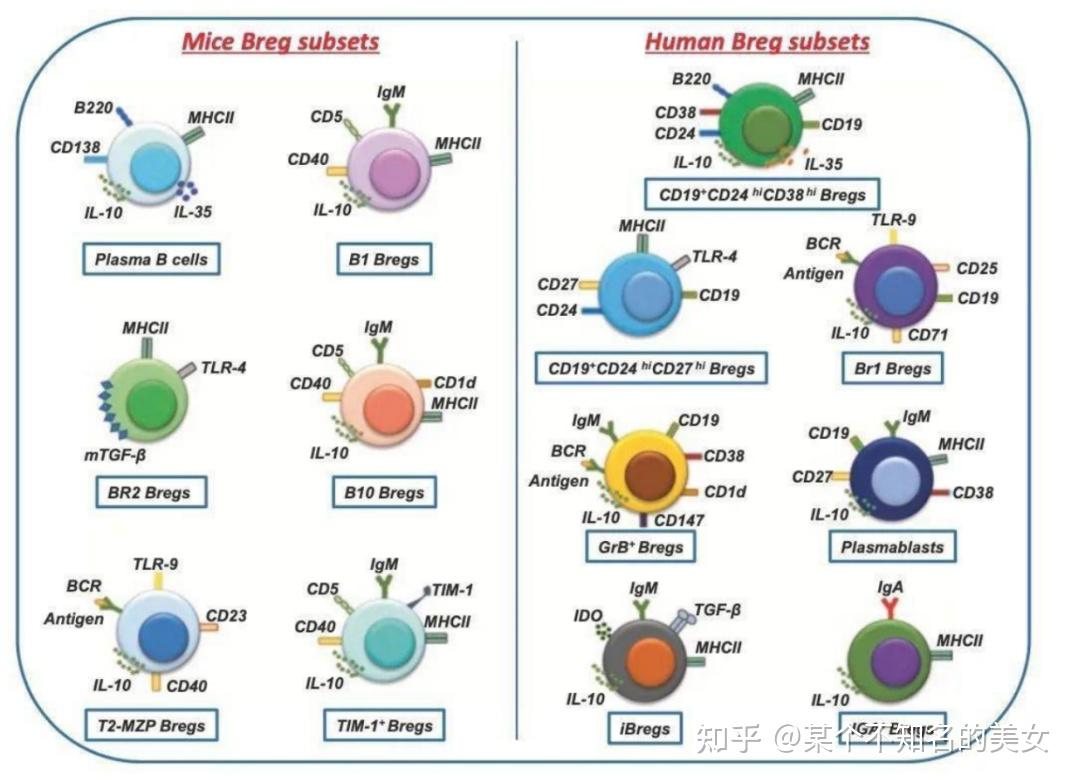
小鼠和人类的BREG亚群
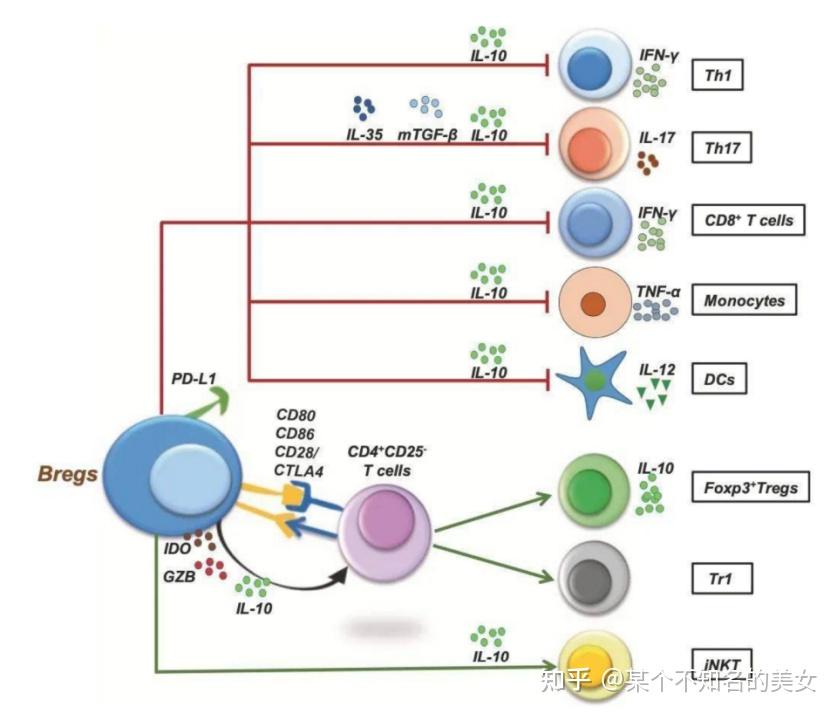
Bregs在各种免疫反应中的调节机制
淋巴细胞归巢:成熟淋巴细胞离开中枢免疫器官后,经血液循环趋向性迁移并定居于外周免疫器官或组织的特定区域,如T细胞定居于副皮质区,B细胞定居于浅皮质区,不同功能的淋巴细胞亚群也可选择性迁移至不同的淋巴组织。
淋巴细胞再循环:指周围淋巴器官和淋巴组织内的淋巴细胞可经淋巴管进入血流循环于全身,它们又可通过毛细血管后微静脉再回入淋巴器官或淋巴组织内,如此周而复始,使淋巴细胞从一个淋巴器官到另一个淋巴器官,从处淋巴组织至另一处淋巴组织,这种现象称为淋巴细胞再循环。
淋巴细胞再循环的作用:有利于识别抗原,促进细胞间的协作,使一些具有相关特异性抗原的细胞共同进行免疫应答,使全身的淋巴细胞成为一个相关连的有机动性的统体。除效应性T细胞、幼浆细胞、K细胞和NK细胞以外,大部分淋巴细胞均参与再循环,尤以记忆性T细胞和记忆性B细胞最为活跃。
其意义有:
(1)使体内淋巴细胞在外周免疫器官和组织的分布更趋合理,有助于增强整个机体的免疫功能;
(2)增加与抗原接触机会,有利于产生初次或再次免疫应答;
(3)使机体所有免疫器官和组织联系成为一个有机整体;
(4)传递免疫信息到全身,有利于免疫细胞的动员和效应细胞的迁移。
1.5 免疫分子
免疫分子指的是由一些免疫活性细胞或相关细胞分泌的参与机体免疫反应或免疫调节的蛋白质及多肽物质,免疫分子通常指免疫球蛋白(Immunoglobulin,Ig)、补体系统(Complement,C)、细胞因子(cytokines,CK)、细胞黏附分子、白细胞分化抗原(CD)等、主要组织相容性抗原(MHC)。
1.5.1 免疫球蛋白
B细胞接受抗原刺激后增殖分化成浆细胞产生的糖蛋白与相应抗原特异性结合,主要存在于血清中,有分泌型sIg、膜型mIg。
基本结构:四肽链通过链间二硫键组成H2L2。
重链:五类(isotype:α、γ、μ、δ、ε);
轻链:两型(λ、κ)。
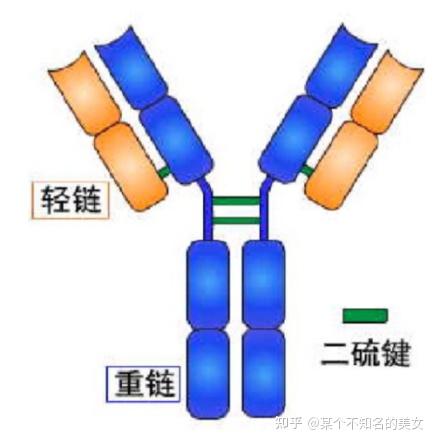
免疫球蛋白分子基本结构
三个功能区:
可变区(Variable region,VH/VL, Fv),结合抗原;
恒定区(Constant region, CH/CL);
绞链区(Hinge region)。
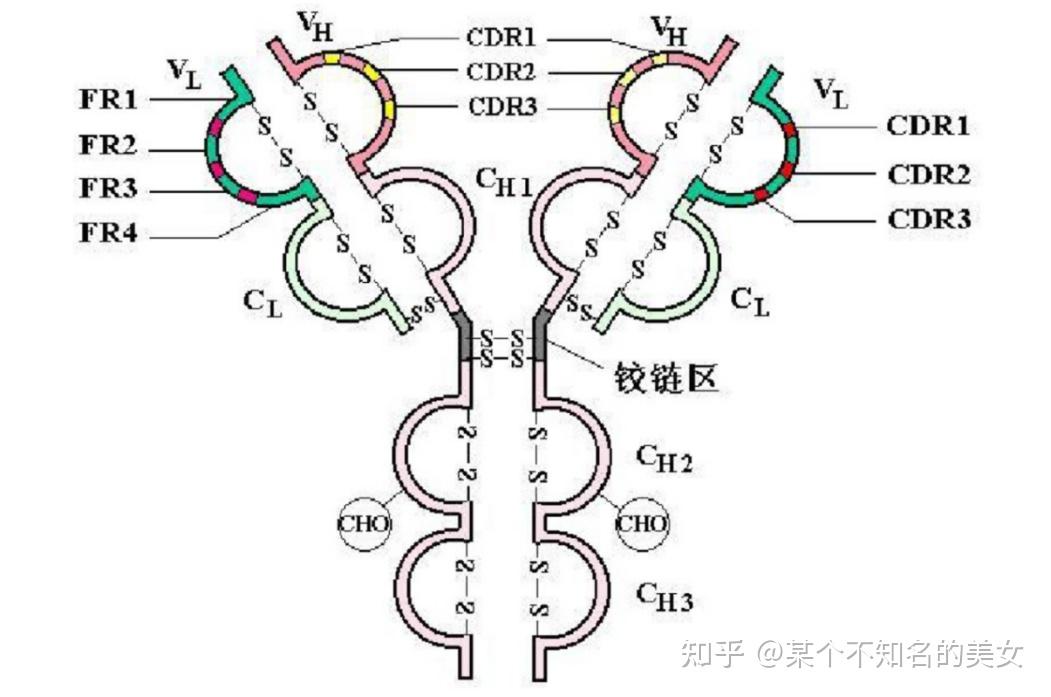
免疫球蛋白功能区结构示意图
各类抗体的特性与功能:
(1)IgG,四个亚类,分布广、血清含量最高、唯一能通过胎盘;
(2)IgM,五个单体J链连接,最早、可诊断宫内及近期感染;
(3)IgA,单体血清,双体外分泌液;
(4)IgD,含量低、B细胞成熟标志;
(5)IgE,含量最低、亲细胞、超敏反应/寄生虫免疫。
IgM,为五聚体,是分子量最大的Ig,又称巨球蛋白,半衰期5-10天,IgM不能通过血管壁,主要存在于血液和粘膜表面,是接种疫苗或感染病原体后最先产生的高效抗体,是免疫反应中的先锋部队,对发现早期感染意义非常大。在个体发育过程和体液免疫应答中IgM均是最早合成和分泌的抗体蛋白,天然抗A与抗B血型凝集素、类风湿因子、冷凝集素等均属于IgM抗体。IgM增高:见于病毒、细菌、寄生虫感染等早期,类风湿性关节炎、硬皮病、巨球蛋白血症等。IgM降低:见于先天性和获得性免疫缺陷病、蛋白丢失性疾病如肾病综合征、蛋白丢失性肠病、皮肤大面积烧伤等。
IgG是血清免疫球蛋白的主要成分,它占总的免疫球蛋白的75%,是病原体感染后出现较晚的抗体,半衰期最长,为23天,是初级免疫应答中最持久、最重要的抗体,具有抗病毒、抗菌和抗毒素作用,在抗感染中起到主力作用。临床上为增强免疫力使用的被动免疫药物如注射用丙种球蛋白的主要成分就是IgG,在抢救危重病毒感染患者时,输入已经患过该病患者的恢复期血浆也可起到一定的疗效。IgG增高:见于各种慢性感染,如结核病、麻风、放线菌病等;慢性肝病如慢性病毒性活动性肝炎、隐匿性肝硬化等;结缔组织病如系统性红斑狼疮、类风湿性关节炎、硬皮病、干燥综合征等;IgG型多发性骨髓瘤、原发性单克隆丙种球蛋白血症等。IgG降低:见于各种先天性和获得性无丙种球蛋白缺陷病、重链病、轻链病、肾病综合征;使用免疫抑制剂(如环磷酰胺、皮质激素等)和放射线照射、甲状腺功能亢进、肌营养不良等。
IgA分为血清型和分泌型,血清型为单体,占血清免疫球蛋白总量的5%-25%,主要存在于血清中;分泌型为二聚体,主要分布在呼吸道粘膜、消化道粘膜和尿道粘膜等,以单体形式存在,是参与粘膜局部免疫的主要抗体,相当于人体防御的第一道防线。分泌型IgA合成不足可能会引起新生儿易患呼吸道、消化道感染。分泌型IgA不易被蛋白酶消化,故有强大防御病原微生物侵害的作用,婴儿可从母乳中获得IgA,是一种重要的自然被动免疫。IgA增高:见于慢性感染、慢性肝病、多发性骨髓瘤、系统性红斑狼疮、类风湿性关节炎、IgA肾病等。IgA降低:见于先天性和获得性免疫缺陷病,蛋白质丢失性疾病等。
IgD主要是扁桃体、脾等处的浆细胞产生,为单体分子,占血清Ig总量的1%,在血清中确切功能仍不清楚,其主要生理功能可能与防止免疫耐受及某些超敏反应有关;IgD可作为膜受体存在于B细胞表面,其作用可能是参与启动B细胞产生抗体,正常人血清IgD浓度很低,平均约0.03毫克每毫升。半寿期很短B细胞表面的mIgD可作为B细胞分化发育成熟的标志。IgD增高:见于IgD型多发性骨髓瘤、慢性骨髓炎、流行性出血热、肝硬化、变态反应性疾病、桥本氏甲状腺炎和病毒感染性疾病等。IgD降低:见于原发性无丙种球蛋白血症、5夕肺、细胞毒药物治疗后。
IgE又称反应素,在血清中的含量极低,对寄生虫感染有重要作用,IgE可与肥大细胞、嗜碱性粒细胞表面的FcεR结合。主要引起由IgE介导的过敏反应。IgE增高:见于过敏性疾病如过敏性鼻炎、外源性哮喘、变应性皮炎、慢性荨麻疹等;寄生虫感染,IgE型多发性骨髓瘤,真菌感染等。IgE降低:见于先天性或获得性丙种球蛋白缺乏症、毛细血管扩张性共济失调症、免疫抑制治疗等。
1.5.2 补体系统
补体存在于人血清、组织液和细胞膜表面的一组经活化后具有酶活性的蛋白质,具非特异性免疫作用,补体以酶原状态存在,被激活后才发挥作用。
补体系统组成:
(1)补体固有成分C1(C1q,C1r,C1s)-C9、B、D、P因子、MBL、丝氨酸蛋白酶;
(2)补体调节蛋白,调控补体和活化强度和范围;
(3)补体受体C1qR、CR1、CR2、CR3、C3aR、C5aR等。
补体的激活按其起始顺序的不同,可分为三条途径,即经典途径(Classical Pathway)、旁路途径(Alternative Pathway)、MBL途径(MBL pathway)。
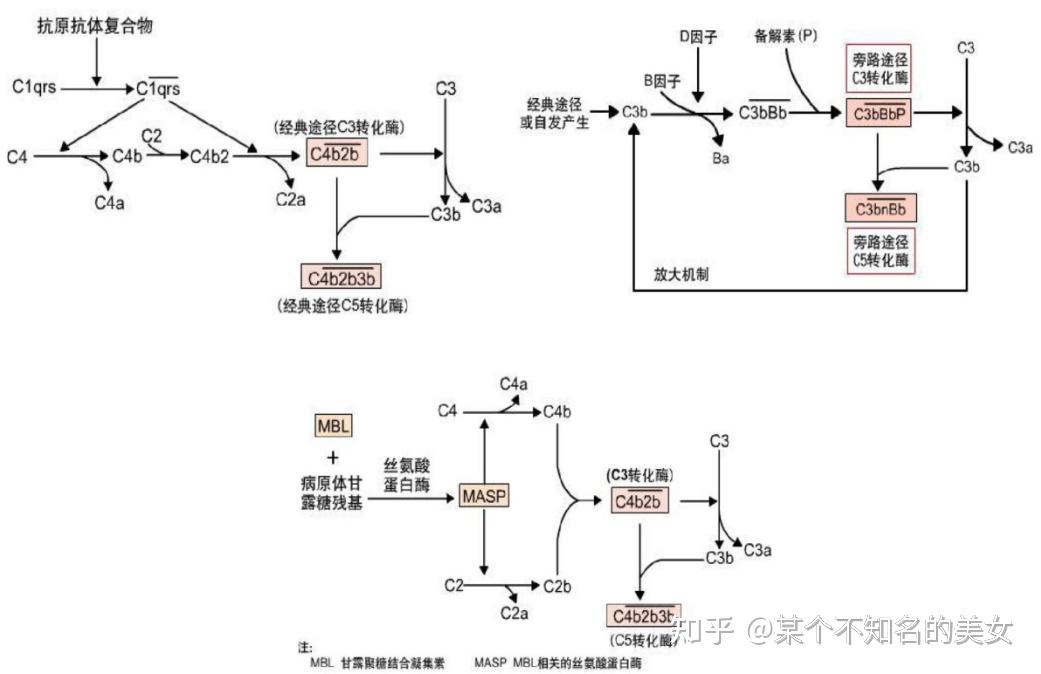
补体激活的3中途径
补体的功能:
(1)溶细胞、溶菌及抗病毒作用;
(2)调理作用,促进吞噬;
(3)引起炎症反应;
(4)清除免疫复合物;
(5)参与适应性免疫应答;
(6)与其他各系统间相互作用;
(7)补体系统异常与疾病。
1.5.3 细胞因子
由机体各种细胞合成分泌的具有多种生理活性和参与病理反应的小分子可溶性蛋白质。细胞因子可分为淋巴因子(IL-2、3、4、5、6、9、10、11、12、13、TNF-β、IFN)和单核因子(IL-1、8、TNF-α、IFN-γ)。
功能分类分为:白细胞介素(Interleukin,IL)、干扰素(Interferon,IFN)、集落刺激因子(Colony Stimulating Factor,CSF)、肿瘤坏死因子(Tumor Necrosis Factor,TNF)、生长因子(Growth Factor,GF)、趋化因子(Chemokine CK)。
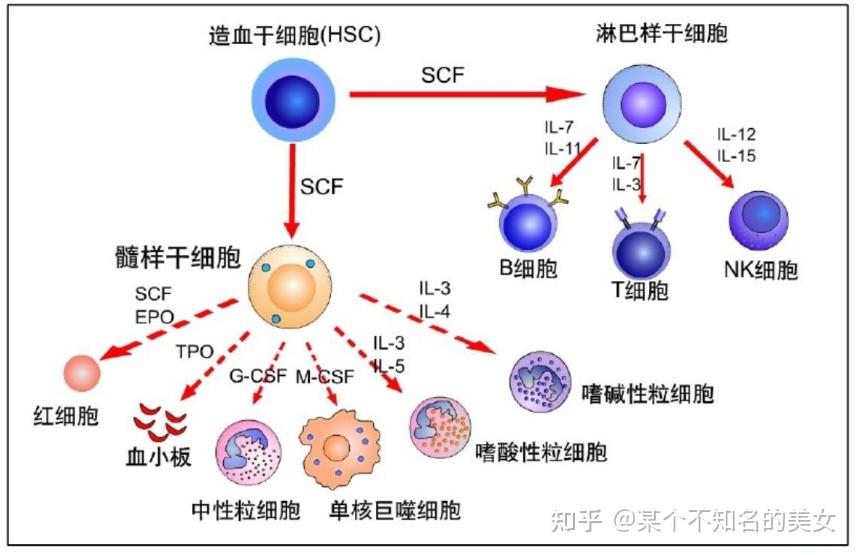
各类细胞因子在造血过程中的应用
1.5.3.1 白细胞介素
功能:
(1)产生细胞(淋巴细胞、单核吞噬细胞等);
(2)介导白细胞间相互作用、调节细胞的生长分化、参与免疫应答和介导炎症反应。
IL-1,促进T、B细胞增殖分化;
IL-2,T细胞生长因子,增强NK细胞和LAK细胞的杀伤活性;
IL-3,刺激骨髓多能干细胞的增殖分化;
IL-4,促进B细胞增殖分化,诱导B细胞发生Ig类别转换,产生IgE或IgG类抗体,抑制Th1细胞;
IL-5,促进B细胞增殖分化,诱导B细胞发生Ig类别转换,产生IgA类抗体,刺激T细胞增殖分化
IL-6,促进T、B细胞增殖分化;
IL-7,诱导胸腺细胞分化、前T和前B增殖;
IL-8,趋化因子;
IL-10,抑制性细胞因子,抑制TH1细胞合成分泌细胞因子;
IL-13,抑制单核巨噬细胞合成分泌炎性细胞因子(IL-1、6、8和TNF-α)。
1.5.3.2 干扰素
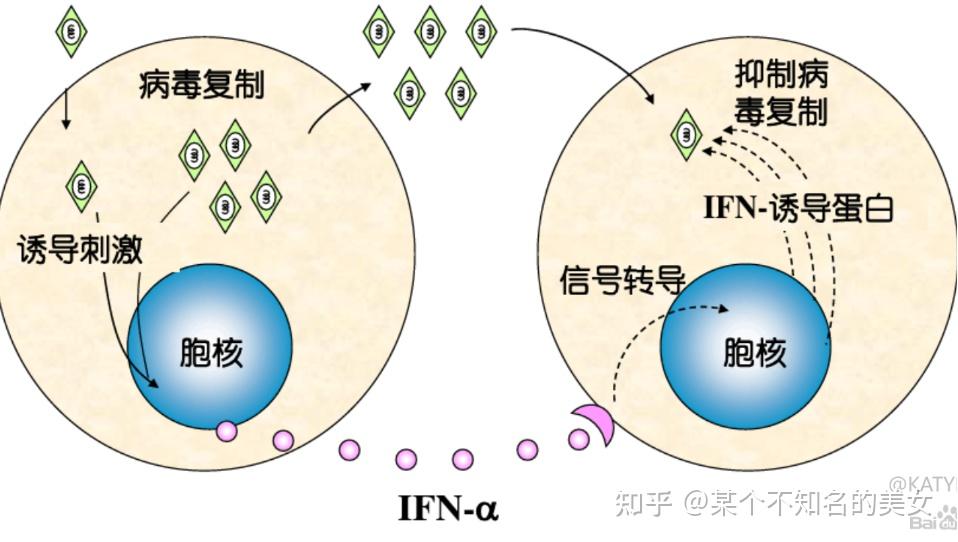
抵抗病毒的感染,干扰病毒复制的细胞因子,包括IFNα、β、γ。
I型干扰素:干扰素IFNα、β,来自于白细胞、成纤维细胞、病毒感染的组织细胞等,其功能主要有抗病毒感染、抗肿瘤生长、免疫调节(较弱),一般应用在病毒感染性疾病如肝炎、SARS等。
Ⅱ型干扰素,干扰素IFNγ,来源主要是活化的T细胞和NK细胞,具有免疫调节功能,提高单核巨噬细胞、树突状细胞的抗原递呈能力,增强Tc细胞和NK细胞的杀伤活性,抑制TH2细胞形成,下调体液免疫应答趋化作用,以及抗病毒和抗肿瘤作用。
1.5.3.3 肿瘤坏死因子
可以直接诱导肿瘤细胞凋亡的细胞因子。分为TNFα和TNFβ,TNFα由活化的单核巨噬细胞产生,亦称恶液质素,TNFβ由活化的T细胞产生,亦称淋巴毒素。两种TNF的分子量为51 kD,结构为同源三聚体,具有相同的结合受体和生物学活性。
TNF的生物学活性有:
(1)杀瘤、抑瘤作用,直接杀伤或抑制肿瘤细胞,激活NK细胞和巨噬细胞,间接发挥作用,损伤血管内皮细胞,促进血栓的形成,阻断肿瘤组织的血流供应,导致肿瘤出血坏死;
(2)免疫调节作用,刺激靶细胞合成分泌细胞因子,如IL-1、IL-6、IL-8等,增强T、B细胞对抗原和有丝分裂原的增殖反应,增强Tc细胞对靶细胞的杀伤活性;
(3)促进炎症反应,诱导血管内皮细胞表达细胞间粘附分子-1(ICAM-1),分泌IL-1、IL-8等炎症分子和趋化因子,增强中性粒细胞和单核吞噬细胞的吞噬功能;
(4)抗病毒作用,类似于IFN的作用或直接杀伤病毒感染细胞;
(5)致热作用内热性热源质,直接作用于下丘脑体温调节中枢,刺激巨噬细胞释放IL-1;
(6)引发恶液质,由TNFα引起,能够促进蛋白脂肪消耗、分解,引起代谢紊乱,表现为厌食、恶心、消瘦、衰弱和贫血。
1.5.3.4 集落刺激因子
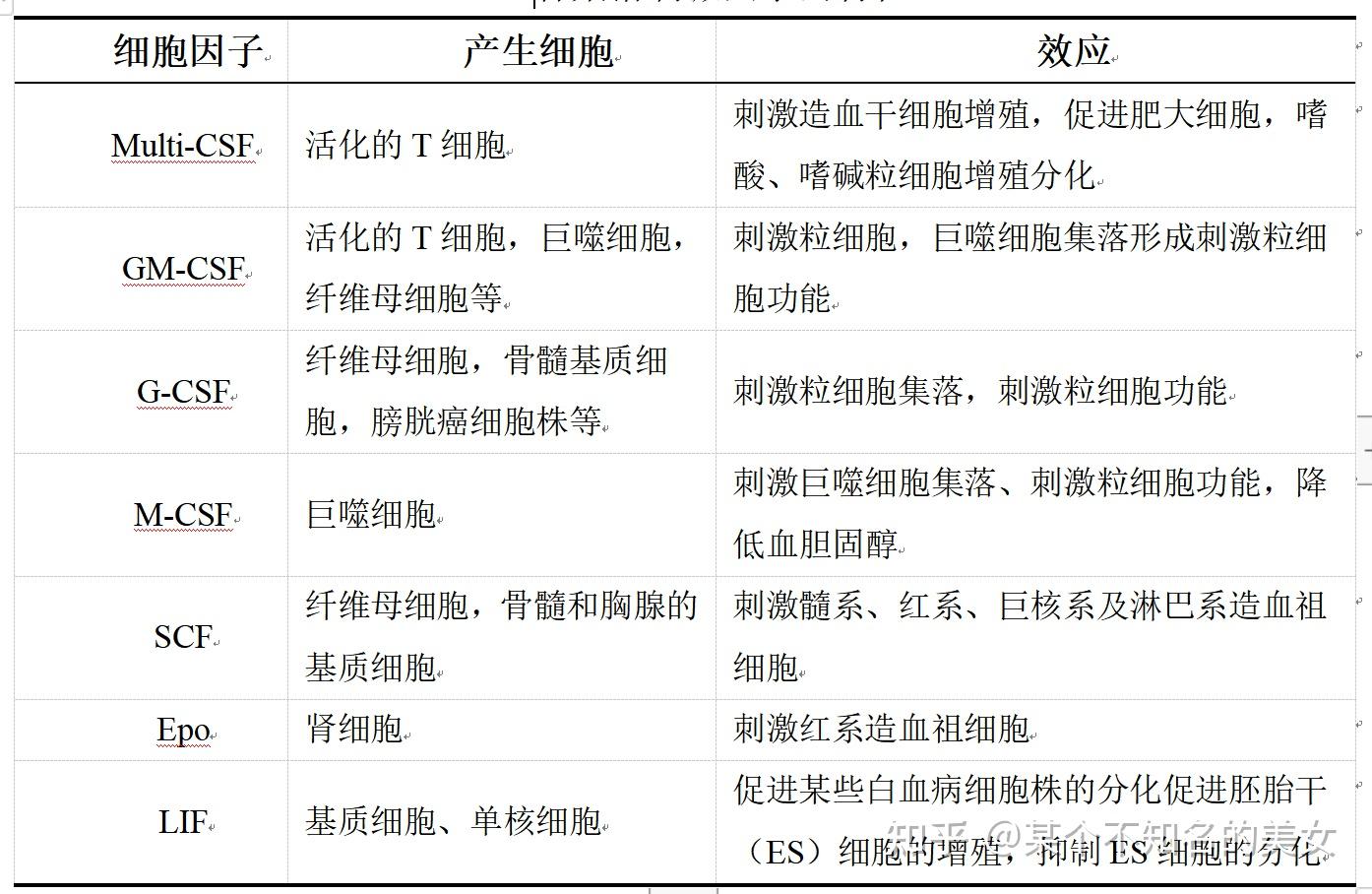
分类:粒细胞集落刺激因子(Granulocyte-CSF,G-CSF)、多能集落刺激因子(Multi-CSF,又称IL-3)、巨噬细胞集落刺激因子(Macrophage-CSF,M-CSF)、粒细胞-巨噬细胞集落刺激因子(Granulocyte-maceo Phage-CSF,GM-CSF)、红细胞生成素(Erythropoietin,EPO)、干细胞生成因子(Stem Cell Factor,SCF)、白血病抑制因子(Leukemia Inhibitory Factor,LIF)。
各集落刺激因子的特性
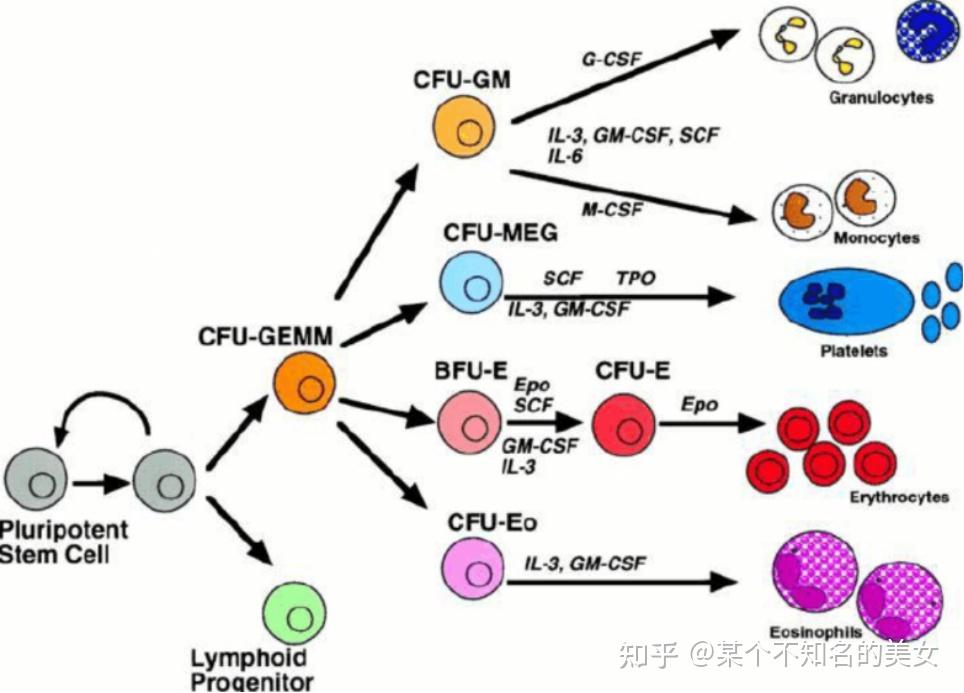
集落刺激因子的作用
1.5.3.5 生长因子
具有促进不同类型细胞生长效应的细胞因子分类:
转化生长因子β (Transforming Growth Factor-β,TGFβ)
表皮生长因子(Epidermal Growth Factor,EGF)
血管内皮生长因子(Vascular Endothelial Growth factor,VEGF)
成纤维细胞生长因子(Fibroblast Growth Factor,FGF)
神经生长因子(Nerve Growth Factor,NGF)
血小板衍生的生长因子(Platelet Derived Growth Factor,PDGF)
肝细胞生长因子(Hepatic Growth Factor,HGF)
生物学活性:
(1)对造血干细胞、上皮细胞、血管内皮细胞、T细胞和B细胞具有生长抑制作用,但对肿瘤细胞的生长无抑制作用;
(2)抑制IL-2诱导的T、B细胞活化;
(3)抑制巨噬细胞、NK细胞、LAK细胞和Tc细胞的杀伤活性;
(4)促进间质细胞增殖,对成纤维细胞、成骨细胞和平滑肌细胞等促分裂作用;
(5)对单核细胞和成纤维细胞具有趋化作用,促进伤口愈合;
(6)促进细胞外基质如胶原蛋白和纤粘连蛋白的生成,在细胞形态维持和增殖、分化过程中起重要作用,有利于胚胎发育和细胞修复。
1.5.3.6 趋化因子
一组具有趋化作用的细胞因子,能吸引免疫细胞到免疫应答局部,参与免疫调节和免疫病理反应。
根据蛋白质的一级结构进行分类:
CXC(α)趋化因子
CC(β)趋化因子
C(γ)趋化因子
CX3C(δ)趋化因子
其中C为半胱氨酸,X为任意氨基酸。
理化特性和分泌特点:分泌型小分子糖蛋白(MW<60kD),单链或双链,TNF三聚体;具有旁分泌(Paracrine)和自分泌(Autocrine)效应;内分泌IL-1和Multi-CSF。
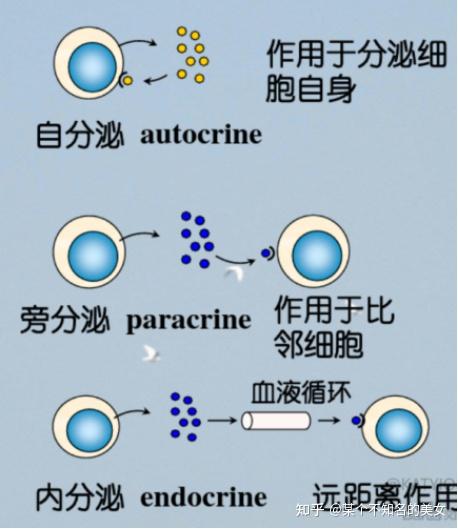
细胞因子分泌的方式
细胞因子产生具有多源性:
(1)活化的免疫细胞;
(2)基质细胞,血管内皮细胞,上皮细胞等;
(3)某些肿瘤细胞,骨髓瘤细胞。
细胞因子产生具有多向性:
(1)一种细胞可分泌多种细胞因子;
(2)几种不同的细胞可产生一种或几种相同的细胞因子;
(3)一种细胞因子可以作用于不同的细胞。
细胞因子的作用特点:
(1)发挥效应具有非特异性,无抗原特异性和MHC限制性;
(2)通过与其受体结合而发挥效应,量微而作用强;
(3)发挥效应的多效性;发挥效应的重叠性;
(4)发挥效应的拮抗性、协同性、增强性和网络性;
(5)具有双重作用,有利于免疫调节、促进造血、抗感染,抗肿瘤,有害方面包括炎症、休克、发热、自身免疫病、肿瘤等。
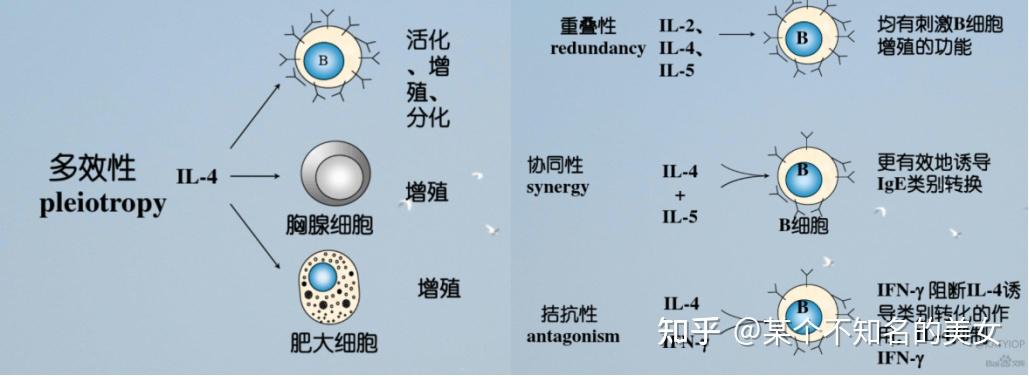
1.5.4 细胞黏附因子
细胞粘附分子(Cell Adhesion Molecule,CAM),又称细胞粘附受体,位于细胞表面,主要介导细胞间及细胞与细胞外基质之间相互作用,以配体-受体结合的形式发挥作用。可分为五大家族:钙粘素、选择凝集素、免疫球蛋白超家族、整合素及透明质酸粘素。
细胞粘附分子结构特点:细胞粘附分子都是跨膜糖蛋白(糖脂)。
分子结构由三部分组成:
(1)胞外区,肽链的N端部分,带有糖链,负责与配体的识别;
(2)跨膜区,多为一次跨膜;
(3)胞质区,肽链的C端部分,与质膜下的骨架成分直接相连,或与胞内的化学信号分子相连,以活化信号转导途径。
1.5.4.1 钙粘素
钙粘素(Cadherin)属亲同性CAM,其配体是自身同型细胞的钙粘素,它们的作用依赖于Ca2+,介导同型细胞间的粘附作用,对组织和器官的发育及维持完整组织结构起重要作用。钙粘素分子结构同源性很高,其胞外部分形成5个结构域,其中4个同源,均含Ca2+结合部位,胞质部分是最高度保守的区域,参与信号转导。
作用:
(1)介导细胞连接,E-钙粘素是保持上皮细胞相互粘合的主要CAM,是粘合带及桥粒中的主要构成成分;
(2)参与细胞分化,钙粘素对于胚胎细胞的早期分化及成体组织(尤其是上皮及神经组织)的构筑有重要作用;抑制细胞迁移。
1.5.4.2 选择凝集素
选择凝集素(Selectin,由select和lectin两词合成),属亲异性CAM,其作用依赖于Ca2+,选择凝集素是一类涉及白细胞及内皮细胞的粘附分子家族,主要参与白细胞与脉管内皮细胞之间的识别与粘合。
已知的选择凝集素有三种:
L(Leukocyte)-选择凝集素
E(Endothelial)-选择凝集素
P(Platelet)-选择凝集素
该类分子为高度糖基化的单链跨膜糖蛋白,其特点是N端有外源凝集素样功能区、表皮生长因子样功能区,及补体结合蛋白重复序列(跨膜区和胞质区)。
1.5.4.3 免疫球蛋白超家族
免疫球蛋白超家族(Ig-Superfamily,Ig-SF)包括分子结构中含有免疫球蛋白(Ig)样结构域的所有分子,其中某些成员属于CAM,它们介导同亲性或异亲性细胞粘着,但其粘着作用不依赖Ca2+。
该家族成员有:
免疫球蛋白
细胞间粘附分子(ICAM-1、ICAM-2、N-CAMs)
血管细胞粘附分子(VCAM-1)
淋巴细胞功能相关抗原(LFA-3)
T细胞受体
B细胞受体
MHC。
1.5.4.4 整合素
整合素(Integrin)也称膜整联蛋白,是由多种跨膜糖蛋白受体组成的家族,大多为亲异性CAM,其作用依赖于Ca2+。几乎所有动植物细胞均表达整合素,整合素分子均由α链(120~185 kD)和β链(90~110 kD),以非共价键连接组成异二聚体,α和β链均为单次跨膜糖蛋白。整合素分子均由胞外区、跨膜区和胞质区3个区域组成,胞外区可与多种配体结合,包括细胞外基质蛋白ECM,如纤粘蛋白、体外粘连蛋白(Vitronectin)、层粘蛋白和胶原蛋白等,以及其它细胞表面受体(ICAM-1,VCAM-1等)。许多整合素分子可识别ECM分子上普遍存在的三肽序列(Arg-Gly-Asp,RGD)。α亚单位的N端有结合Ca2+的结构域,胞质区近膜处都有一个非常保守的XGFFKR(AspXAspXAspGlyXXAsp)序列,与整合素活性的调节有关。
整合素的活化:介导细胞间黏着的整合素通常不与配体结合,需活化后才具有与配体结合的能力。活性过程实际上是胞内信号引起整合素分子胞外识别与结合的结构域活化,导致整合素与配体结合,这一过程称为胞内信号外传(Inside out Signaling)。整合素与配体结合后,通过细胞骨架或信号转导体系将信号内传,引起细胞发生反应,这一过程称为胞外信号内传(Outside in Signaling)。活化的整合素又可失活,导致黏附的细胞相互脱离。
整合素的作用,整合素家族是介导细胞与细胞外基质相互作用的最主要的分子。整合素是多数细胞外基质蛋白的受体,能识别、结合细胞外基质中相应的配体,为细胞黏附提供附着点,介导细胞与细胞之间、细胞与细胞外基质之间的粘附,使细胞粘在一起,形成一个整体。同时调整细胞骨架结构,调节蛋白的磷酸化水平和基因表达,从而调控细胞的运动、增殖和凋亡。
1.5.4.5 透明质酸粘素
透明质酸粘素(Hyaladherin)也称透明质酸连接蛋白(Hyaluronan-Binding Proteins),包括可结合透明质酸糖链的一类分子,它们具有相似的氨基酸序列和空间构象。CD44是其中的一个成员,分子量范围为85~250 KD,介导细胞与细胞间及细胞与细胞外基质间的相互作用,同样是由胞外,跨膜及胞质三个部分构成的糖蛋白,糖链为硫酸软骨素及硫酸乙酰肝素,CD44肽链的N端可结合透明质酸,故CD44也被视为透明质酸的受体。
透明质酸粘素的功能:
(1)与透明质酸、纤粘连蛋白及胶原结合,介导细胞与细胞外基质之间的粘附;
(2)参与细胞对透明质酸的摄取及降解;
(3)细胞内信号转导;
(4)促进细胞的迁移和分化。
透明质酸是增殖细胞和迁移细胞的胞外基质主要成分,也是蛋白聚糖的主要结构组分,透明质酸在结缔组织中起强化、弹性和润滑作用,透明质酸使细胞保持彼此分离,使细胞易于运动迁移和增殖并阻止细胞分化。
1.5.5 白细胞分化抗原
白细胞分化抗原(Cluster of Differentiation,CD):指不同谱系白细胞在分化成熟的不同阶段以及活化过程中,出现或消失的表面标记,它们大都为跨膜分子,由胞外区、跨膜区和胞浆区组成,有些以糖基磷脂酰肌醇(GPI),它们大都是蛋白或糖蛋白,少数为碳水化合物。
用以单克隆抗体鉴定为主的聚类分析法,将来自不同实验室的单克隆抗体所识别的同一分化抗原归为一个分化群,并以此代替分化抗原以往的命名。在许多情况下,单克隆抗体及其识别的相应抗原都用同一个CD序号,迄今为止,人CD分子的序号已从CD1命名至CD364,可大致划分为14个组。
白细胞分化抗原的主要生物学作用:
(1)表面标志,代表不同谱系,不同分化阶段,活化阶段;
(2)参与机体重要的生理、病理过程,免疫应答过程中参与免疫细胞的相互识别,免疫细胞识别抗原、活化、增殖和分化,免疫效应功能的发挥,参与造血细胞的分化和造血过程的调控;
(3)参与炎症的发生;
(4)参与细胞的迁移如肿瘤细胞的转移等。
1.5.6 主要组织相容性复合体
主要组织相容性复合体(Major Histocompatibility Complex,MHC)是一组编码动物主要组织相容性抗原的基因群的统称,人类的MHC被称为HLA(Human Leukocyte Antigen,HLA),即人类白细胞抗原,小鼠MHC则被称为H-2,HLA位于人的6号染色体短臂上,H-2位于小鼠的17号染色体上。MHC可以分为经典MHC与非经典MHC两类,经典MHC包括MHC I、MHC II、MHC III基因,分别编码MHC I分子、MHC II分子、MHC III分子。
根据基因的位置和功能,主要组织相容性复合体分为三类,分别为:
MHC class I:位于一般细胞表面上,可以提供一般细胞内的一些状况,比如该细胞遭受病毒感染,则将病毒外膜碎片之氨基酸链(peptide)透过MHC提示在细胞外侧,可以供杀手CD8+ T细胞等辨识,以进行扑杀;
MHC class II:大多位于抗原呈递细胞(APC上),如巨噬细胞等,这类提供则是细胞外部的情况,像是组织中有细菌侵入,则巨噬细胞进行吞食后,把细菌碎片利用MHC提供给辅助T细胞,启动免疫反应;
MHC class III:主要编码补体成分,肿瘤坏死因子(TNF),热休克蛋白70(HSP70)和21羟化酶基因(CYP21A和CYP21B)。
生理意义:
(1)MHC抗原最初是作为移植抗原而被发现的,是引起移植排斥的主要抗原系统。这种抗原不合,即可引起受体的免疫应答,排斥移植的供体组织。MHC分子在免疫应答过程中参与抗原识别。70年代R.M.津克纳泽尔等在小鼠实验中发现杀伤T细胞在杀伤感染病毒的靶细胞时,只能杀伤同系感染靶细胞,而对不同系的感染靶细胞则无杀伤作用,称这种现象为遗传限制性。随后证明杀伤T细胞与靶细胞的MHC必需一致才有杀伤作用,因此又称此现象为MHC限制性。
(2)人们还发现外周血B细胞和单核细胞等非T细胞在体外能诱导某些自身反应性T细胞发生增殖反应,称这种现象为自身混合淋巴细胞反应(AMLR),并证明这是由非T细胞上MHCⅡ类抗原引起的。这种自身反应性T细胞在体内可能具有增强或抑制免疫功能的作用,借以维持机体的免疫稳定性,因此MHC分子也参与免疫调节作用。
(3)MHC分子对T细胞在胸腺内的分化成熟过程也起重要作用,体外研究发现,去除胸腺中MHCⅡ类抗原阳性的基质细胞,则T4T细胞的发育受阻,在胸腺培养细胞中加入抗MHCⅡ类抗原的单克隆抗体,也能阻止T4T细胞的发育。认为MHC分子在T细胞自身耐受的形成和T细胞库的产生中都起着重要作用。
(4)MHC不仅控制着同种移植排斥反应,更重要的是与机体免疫应答、免疫调节及某些病理状态的产生均密切相关。因此,MHC的完整概念是指脊椎动物某一染色体上编码主要组织相容性抗原、控制细胞间相互识别、调节免疫应答的一组紧密连锁基因群。
1.6 肠屏障
肠屏障是指肠道能防止肠腔内的有害物质如细菌和内毒素穿过肠黏膜进入体内其他组织器官和血液循环的结构和功能的总和。正常肠道具有将肠腔内物质与机体内环境隔离的功能,防止致病性抗原(肠腔内细菌、有毒物质、食物抗原等)侵入黏膜下层组织,维持机体内环境的相对稳定和机体的正常生命活动。
肠屏障由机械屏障(Mechanical Barrier)、化学屏障(Chemical Barrier)、微生物屏障(Microbiological Barrier、免疫屏障(Immunological Barrier)组成。肠道的机械屏障、化学屏障、微生物屏障属于机体固有免疫功能,免疫屏障属于机体的适应性免疫范畴。
肠屏障功能损害:在饥饿和营养不良、创伤、危重疾病、严重感染或炎症等情况下,肠黏膜的结构和功能可能受到损伤,导致肠黏膜屏障功能障碍、肠道细菌移位、内毒素入侵,诱发或加重肠道局部或全身性炎症、免疫反应,严重者可导致多器官功能不全的发生。

肠屏障治疗关键
1.6.1 机械屏障
机械屏障又称为物理屏障,主要由肠黏膜表面的粘液层、肠上皮细胞及其紧密连接、黏膜下固有层等组成。肠黏膜上皮结构的完整性决定肠黏膜机械屏障功能的健全程度。粘液层是上皮机械屏障的第一道防线,也是消化吸收的重要部位,还可为专性厌氧菌的生长及粘附提供适宜的环境,阻止潜在致病菌的定植。其主要成分为粘蛋白,由吸收细胞分泌粘液层的表面还分布着具有保护作用的磷脂,不仅提供了机械性的保护层,因其具有疏水性还可以降低大分子物质的通透性,可抵制毒素的侵袭。
作用:
(1)肠道粘膜上皮的完整性及正常的再生能力是肠粘膜屏障的结构基础;
(2)吸收营养、水和电解质;
(3)限制宿主与有害的腔内抗原的接触;
(4)限制肠腔的大分子物质向肠壁渗透以及肠壁固有层的物质进入肠腔。
1.6.2 化学屏障
肠道分泌的胃酸、胆汁、各种消化酶、溶菌酶、粘多糖、糖蛋白和糖脂等化学物质,也具有屏障作用,称之为化学屏障。胃酸能够杀灭经口入侵的细菌,抑制细菌在肠道上皮的粘附和定植。胆汁中的胆盐可与内毒素结合,胆酸可降解内毒素分子,胆汁中的sIgA可包绕细菌,阻断其粘附。溶菌酶能破坏细菌的细胞壁,使细菌裂解。肠道分泌的大量消化液可稀释毒素,冲洗清洁肠腔,使潜在的条件致病菌难以粘附到肠上皮上。肠黏膜中杯状细胞分泌液中所含的糖蛋白和糖脂,是细菌粘附受体的类似物,可以改变细菌的进攻位点,使细菌与分泌物中糖蛋白、糖脂结合,然后随粪便排出。
作用:
(1)胃酸可杀灭胃肠道的细菌,抑制其在上皮的粘附和定植;
(2)溶菌酶可破坏细菌的细胞壁,使细菌裂解;
(3)补体可增加溶菌酶及免疫球蛋白的抗菌作用;
(4)消化液可稀释毒素,清洁肠腔,条件致病菌难以粘附到肠上皮上;
(5)润滑作用,以保护肠粘膜免受物理化学损伤。
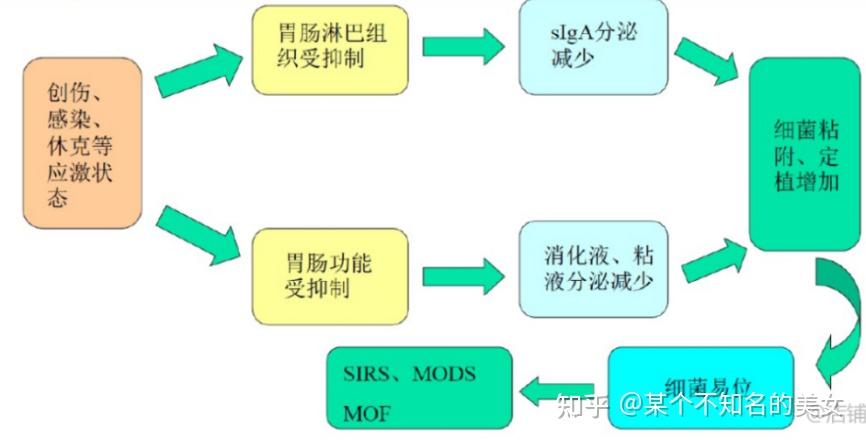
化学屏障损害机制
1.6.3 微生物屏障
动物肠道内存在着多种大量的正常微生物,这些共生的菌群通过与肠黏膜黏附或者结合,形成生物屏障。正常菌群在动物内环境中的定居、繁殖与宿主保持着共生的关系,为宿主提供营养成分,维持肠道微生态平衡。同时它们在动物体内还能增强宿主的黏膜免疫功能,促进免疫器官的发育成熟,提高特异性和非特异性免疫功能,增强巨噬细胞活性及细胞因子介导素的分泌,增强红细胞的免疫功能。对肠道屏障起重要作用的微生物主要是一些专性厌氧菌,包括乳酸杆菌、双歧杆菌。这些专性厌氧菌通过粘附作用与肠上皮紧密结合,形成菌膜屏障,可以竞争抑制肠道中致病菌与肠,上皮结合,抑制它们的定植和生长;也可分泌醋酸、乳酸、短链脂肪酸等,降低肠道pH值与氧化还原电势及与致病菌竞争利用营养物质,从而抑制致病菌的生长。
正常成人肠道内细菌总重量可达1-1.5公斤,肠道微生态系统是人体最大的微生态系统,专性厌氧菌占据了肠道菌群所有细菌数量的99%以上,是肠道菌群的主体。
作用:
(1)竞争抑制肠道中致病菌与肠上皮结合,抑制其定植和生长;
(2)分泌醋酸、乳酸、短链脂肪酸等,降低肠道pH值与氧化还原电势,与致病菌竞争利用营养物质,从而抑制致病菌的生长;
(3)肠粘膜表面的共生菌可直接调节肠道抗感染能力。
1.6.4 免疫屏障
免疫屏障肠道是机体接触外界抗原物质最广泛的部位,也是机体中最大的免疫器官。肠道的免疫防御系统主要由肠道相关淋巴组织(Gut Associated Lymphatic Tissue,GALT)构成,肠道相关淋巴组织分为组织性淋巴样组织及散在于整个肠壁的淋巴细胞,主要包括有pp结(Peyerpatches)、肠黏膜孤立淋巴小结、弥散于肠黏膜的巨噬细胞、T辅助细胞、B细胞、浆细胞和.上皮内淋巴细胞等。肠道免疫系统中起核心作用的是分泌性IgA (Secretory IgA,sIgA)。sIgA相对分子质量为36000,主要由淋巴细胞和浆细胞产生,分布于肠黏膜表面,是肠道分泌物中含量最丰富的免疫球蛋白,是阻止病原体入侵的主要免疫防御因子。肠道中sIgA的主要功能是阻止病原体在肠黏膜表面的粘附,中和细菌产生的毒素,中和病毒,增强具有FC受体细胞的吞噬功能,并与补体和溶菌酶协调抗菌。肠道中sIgA减少,可使肠黏膜抗感染免疫屏障功能下降,增加了肠道细菌和内毒与黏膜上皮细胞相互作用的机会,促进了细菌移位和内毒素吸收。
免疫屏障的结构基础:
(1)粘膜上皮内及固有层内的免疫组织:粘膜上皮细胞、上皮内淋巴细胞、固有层浆细胞;
(2)肠壁内淋巴组织:上皮下集合淋巴小结、孤立淋巴小结。
免疫屏障的作用机制:
(1)肠壁内存在的淋巴样组织(小肠最丰富)在抗原刺激下,产生局部免疫反应,中和抗原物质(主要是产生大量sIgA);
(2)sIgA包被细菌,形成抗原抗体复合物,刺激肠道粘液分泌,加速流动,阻止细菌黏附于肠粘膜,使细菌不能从肠内进入肠壁。
作用:
(1)肠粘膜上皮内淋巴细胞起重要作用,其产生的细胞因子可保持肠粘膜屏障完整性;
(2)细胞因子的异常可导致多种肠道疾病;
(3)肠道正常的免疫功能是调控这些细胞因子的保障;
(4)对粘膜表面的抗原具有摄取、处理、呈递作用。
1.7 免疫失调
免疫失调可表现为过敏、自身免疫病、免疫缺陷症。
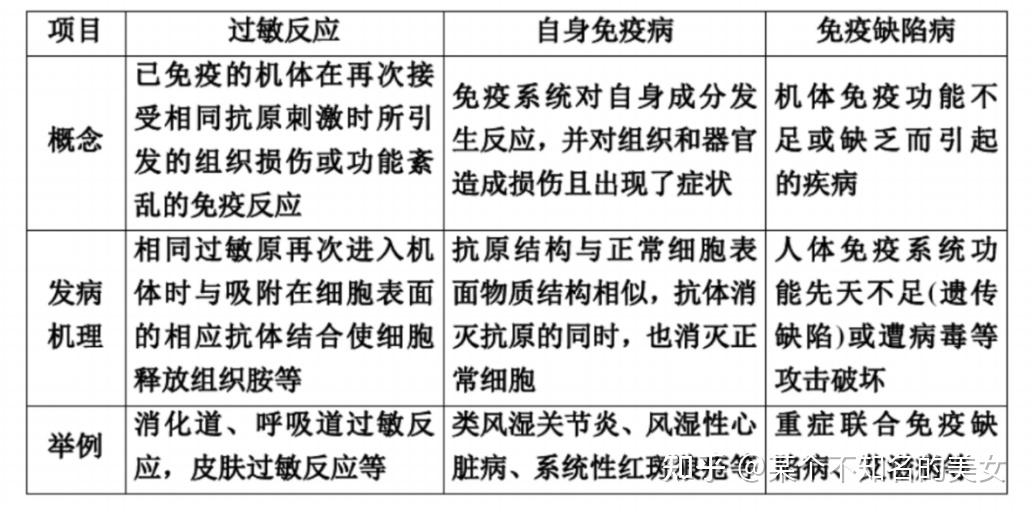
1.7.1 过敏反应
过敏反应(Allergic Reaction),是已免疫的机体,在再次接触相同的抗原时,有时会发生引发组织损伤或功能紊乱的免疫反应,这样的免疫反应称为过敏反应。
过敏原:引起过敏反应的抗原物质叫做过敏原。鱼、牛奶、蛋类、花粉、花生、室内尘土、奎宁、宠物的皮屑、棉絮等都是(或含有)过敏原。
有些人在接触过敏原时,在过敏原的刺激下,B细胞会活化产生抗体,抗体吸附在皮肤、呼吸道或消化道粘膜以及血液中某些细胞(如肥大细胞)的表面。当相同的过敏原再次进入机体时,就会与吸附在细胞表面的相应抗体相结合,使这些细胞释放出组织胺等物质。引发毛细血管扩张血管壁通透性增强平滑肌收缩和腺体分泌增多,最终导致过敏者出现皮肤红肿、打喷嚏、哮喘呼吸困难等症状。
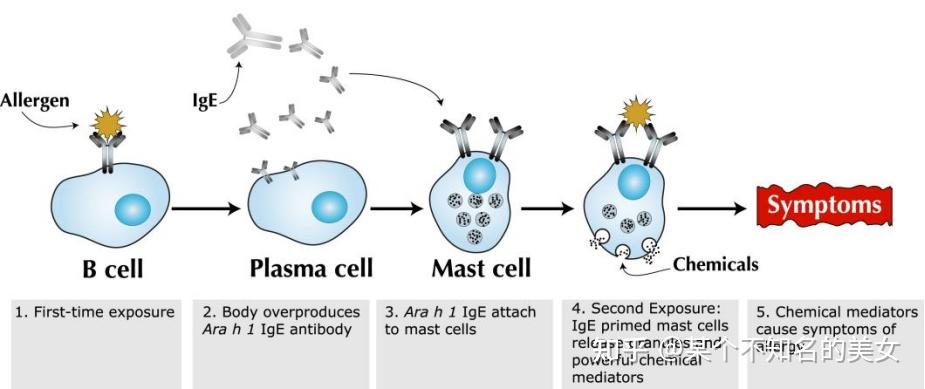
过敏反应机理
1.7.2 自身免疫病
在某些特殊情况下,免疫系统会对自身成分发生反应。如果自身免疫反应对组织和器官造成损伤,并出现了症状就称为自身免疫病。常见的自身免疫病:风湿性心脏病、类风湿关节炎、系统性红斑狼疮等。
过敏反应因免疫反应过强而造成的免疫失调,但通常不损伤组织细胞,而免疫反应过强可能造成不能识别自我成分而患自身免疫疾病。
先天性免疫缺陷病:遗传因素引起,病人免疫力低下,对疾病抵抗力差。如先天性胸腺发育不全、伴湿疹血小板减少的免疫缺陷病、重症联合免疫缺陷病等。
后天性免疫缺陷病:疾病或其他因素(如营养不良、感染、药物、肿瘤、手术、外伤、烧伤、脾切除等。)引起,病人丧失部分或全部的免疫能力。又称获得性免疫缺陷病。
1.7.3 免疫缺陷症
指由于机体免疫功能不足或缺乏而引起的疾病,叫免疫缺陷症。
先天性免疫缺陷病:由遗传引起
获得性免疫缺陷病:由疾病和其他因素引起
1.8 免疫学应用
1.8.1 免疫预防
免疫预防又称预防接种,利用人工制备的各种免疫制剂使个人和人群产生对疾病的特异性免疫。
是将减为预防严重危害人民健康的传染病,我国制定了“计划免疫”的政策,规定所有的人都必须接受计划免疫。我国计划免疫的疫苗有:百白破三联针(预防百日咳、白喉、破伤风)、小儿麻痹症糖丸、卡介苗(预防肺结核)及牛痘(预防天花,已消灭,70年代停止接种)等。
1.8.2 免疫治疗
免疫治疗:是指通过对人体输入抗体、胸腺素、淋巴因子或某些药物等,调整病人的免疫功能,从而达到治病的目的。例如注射含多种抗体的健康人的血清提高抗感染能力。
1.8.3 器官移植
器官移植指用正常的器官置换丧失功能的器官,以重建其生理功能的技术叫做器官移植。器官移植的成败取决于供者和受者的组织相容性抗原,即人类白细胞抗原(HLA),是否一致或相近。
2. 评价内容(参考指南)
2.1 体液免疫功能
血清免疫球蛋白检测(IgG、IgM、IgA)
分泌型IgA(SIgA)的测定
常见抗体的测定(嗜异性凝集素、抗溶血素O抗体以及麻疹病毒、脊髓灰质炎病毒的抗体)
抗体生成细胞检测
B细胞数目、功能检测
血清溶血素检测
2.2 细胞免疫功能
迟发型变态反应
组织病理学观察和原位蛋白表达(免疫组织化学技术)
T淋巴细胞及其亚群和自然杀伤细胞(Natural Killer Cell, NK cell)等数量、比例和功能的检测
特异性免疫分子的测定或其基因表达情况
2.3 吞噬细胞功能
中性粒细胞趋化功能测定,吞噬、杀菌功能检测
巨噬细胞碳粒廓清功能、吞噬功能测定,溶酶体酶测定,细胞毒作用测定,促凝血活性测定
2.4 NK细胞功能
NK活性测定
2.5 细胞因子
细胞因子含量测定
2.6肠道屏障
肠道通透性检测
肠黏膜形态学检测
血浆内毒素水平检测
血浆D-乳酸含量检测
血浆内毒素水平检测
3. 评价方法
3.1 体液免疫功能
3.1.1 血清免疫球蛋白的测定
血清免疫球蛋白(Ig)的测定是检查体液免疫功能最常用的方法。由于还没有发现由IgD和IgE缺陷所致疾病,所以通常检测IgG、IgM、IgA,这三类Ig就可以代表血清Ig的水平。检测发现三类Ig水平均明显低下,就可考虑体液免疫缺陷。体液免疫功能缺陷首先考虑患者血清Ig水平,如果所有类别Ig水平均降低,即称为一般性联低丙种球蛋白血症。如果免疫球蛋白水平极度低下,或IgG、IgM、IgA,三类Ig总量低于2mg/ml则称为严重低丙种球蛋白血症或无丙种球蛋白血症(agammaglobulinemia)。如果只一种或两种Ig水平降低,则称为异常丙种球蛋白血症(dysgammaglobulinemia)。一般性低丙种球蛋白血症多见于继发性免疫缺陷病。无丙种球蛋白血症常见于原发免疫缺陷病。但是常有约50%IgA缺陷病人无临床症状,伴有反复感染的IgA缺陷病人常同时有IgG的缺陷。常规的定量检测血中Ig的方法是单向免疫环状扩散法和免疫比浊法。
3.1.2 分泌型IgA(SIgA)的测定
SIgA是粘膜抗感染的重要因素,但是粘膜抗感染还包括少量渗出的IgM和IgG,还有细胞免疫的作用。由SIgA缺陷病人常可检测出针对牛奶或其他食物蛋白的沉淀抗体和自身抗体,说明机体对抗原蛋白质吸收异常,同时也存在免疫调节系统的功能紊乱。一般来说血清IgA缺陷病人常伴有SIgA缺陷,反之亦然。说明在机体中血清IgA和SIgA之间有某种生物相关性。用免疫比浊法可较精确地测定分泌液中IgA时和IgM和IgC水平。在用单向免疫扩散和免疫比浊法定量IgA时,因抗血清是针对这两型共有的α链的,故不能区分SIgA和血清来源的IgA。而应用抗分泌小体的抗体用酶免疫分析法,可区分血清IgA和分泌型IgA,并可对SIgA进行定量。
3.1.3 常见抗体的测定
检测体液免疫功能的另一种方法是定量测定正常人体内的几种常见的抗体水平。常见的抗体通常是指嗜异性凝集素、抗溶血素O抗体以及麻疹病毒、脊髓灰质炎病毒的抗体。在严重免疫缺陷病人缺乏上述抗体,常见抗体的缺损可验证或支持免疫蛋白测定的结果。然而对于比较复杂的免疫缺陷,由于这类抗体主要反映过去的免疫应答能力,此外这种初次应答能力持续期短,易于消退,所以对新近发生的继发性免疫缺陷的诊断帮助不大。
3.1.4 B细胞
原发性免疫缺陷和继发性免疫缺陷均可导致体液免疫功能下降。原发性体液免疫功能缺陷可能由于B细胞分化障碍,细胞内合成Ig功能紊乱或由于抑制性细胞功能过强。继发性体液免疫功能降低可能由于蛋白质大量丢失,蛋白质吸收障碍、营养不良、免疫抑制治疗的副作用,病毒感染(艾滋病)等。在诊断原发性体液免疫功能缺损中可检查B细胞的数目和功能以确定造成缺损的原因。
3.1.4.1外周血B细胞数目的检测
首先进行常规的外周血白细胞总数和分类计数检查,这些结果是评价病人免疫系统功能状态的基本资料。由于在全血中淋巴细胞所占比例很少,而T细胞和B细胞不能藉形态学特征分类,所以外周血B细胞数检测需先从全血分离出富含淋巴细胞的单个核细胞(peripheral blood mononuclear cell, PBM)。再依靠B细胞表面有免疫球蛋白分子或其他特征来检查B细胞。常用的方法是将待检者的PBM用FITC标记的免疫抗人Ig作直接免疫荧光染色,在荧光显微镜下显荧光的细胞为带有表面免疫球蛋白的B细胞。正常人B细胞的约占PBM的10%。
3.1.4.2 外周血B细胞功能的检测
分离受检者血液PBM细胞,体外培养时加入B细胞刺激物如RWM(美洲商陆刺激素)或SAC(金黄色莆萄球菌来源的刺激物)后由B细胞变成Ig分泌细胞的数量。体液免疫功能缺损患者,其PBM对PWM和SACA刺激的反应降低,产生Ig分泌细胞数正常人显著减少。在进一步检查这种免疫缺损的原因,则应检查是由B细胞或TH细胞缺损所致,还是由于TS细胞数量或活性增强引起的。
3.1.4.3 抗体生成细胞检测
(1) 直接法
主要针对IgM型抗体分泌细胞进行检测,由于IgM型抗体具有比其他种类抗体更高的溶血效率,因此可采用直接溶血空斑法对IgM型抗体进行检测。
(2) 间接法
主要针对溶血效率较低的IgG或IgA型抗体,反应过程中需要加入抗球蛋白抗体辅助溶血空斑的形成。
(3) 改良法(Jerne改良玻片法)
主要解决的问题是传统的溶血空斑实验只能检测针对红细胞抗体的产生。该方法首先用待测抗原免疫小鼠并致敏绵羊红细胞,通过抗原特异性抗体的产生以裂解抗原致敏后的红细胞。改良后的溶血空斑实验扩大了溶血空斑实验的应用范围,使对抗体分泌能力的检测更加系统、全面。
(4) 反向溶血空斑实验
将淋巴细胞在体外用丝裂原诱导活化后,与SPA致敏的绵羊红细胞、二抗以及补体成分相混合,形成溶血空斑后可以对机体中B淋巴细胞克隆抗体分泌的整体能力进行评价。
3.1.5 血清溶血素的测定
血凝法:用SRBC免疫动物后,产生抗SRBC抗体(溶血素),利用其凝集SRBC的程度来检测溶血素的水平。
半数溶血值(HC50)的测定:用SRBC免疫动物后,血清中出现SRBC抗体(溶血素),在补体参与下,与SRBC一起孵育,可发生溶血反应,释放血红蛋白,通过测定血红蛋白含量反映动物血清中溶血素的含量。
3.2 细胞免疫功能
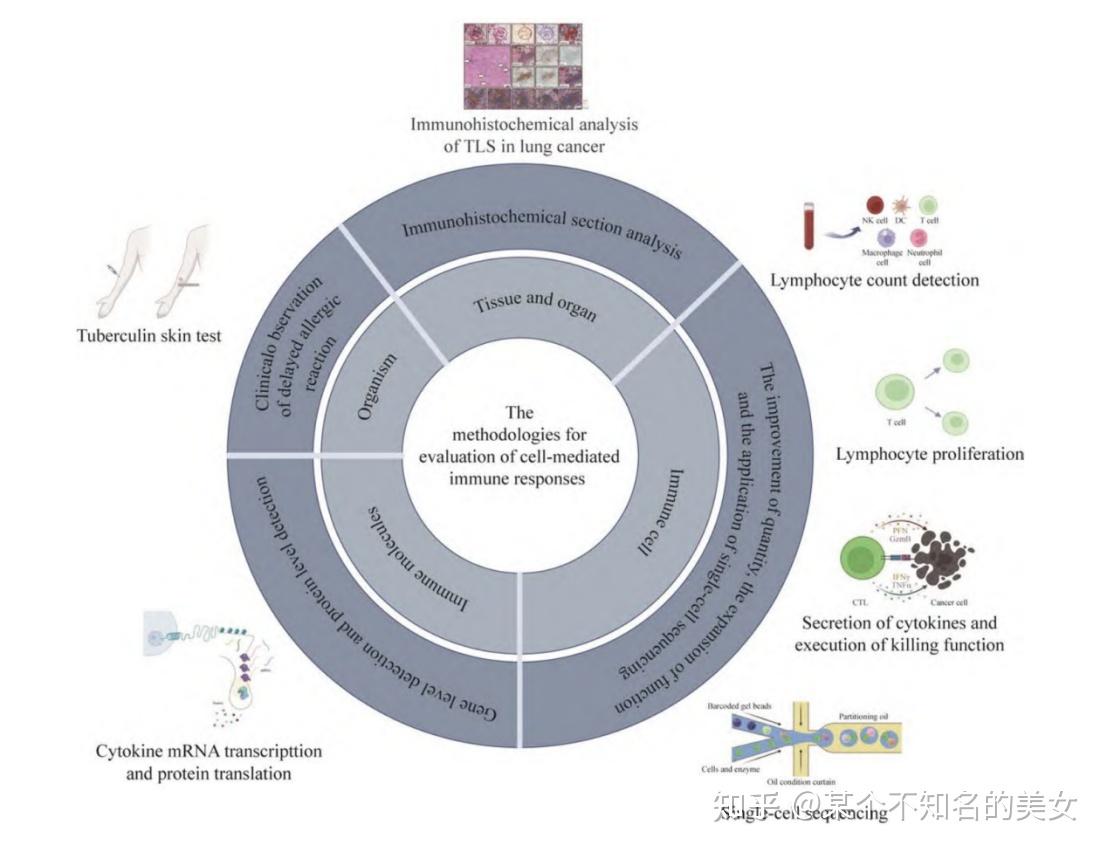
细胞免疫应答评价方法
细胞免疫应答评价方法
注:根据检测水平,细胞免疫应答评价方法可分为机体、组织器官、免疫细胞和免疫分子4个水平。并且,免疫细胞水平是评价细胞免疫应答的主要水平。机体水平依据迟发型过敏反应的临床观察。组织器官水平常见于免疫组化切片分析。免疫细胞水平主要为“量”的提升、“功能”的拓展和单细胞测序的应用。免疫分子水平包括基因水平检测和蛋白水平检测。
3.2.1 机体整体水平
迟发型变态反应(delayed type hypersensitivity, DTH)是机体抵御病原体的主要免疫应答模式,反应结果可指示机体整体的免疫状况,因此,DTH成为细胞免疫功能检测的常用指标。通过皮内注射病原体抗原后48−72 h,观察是否出现红斑、硬块和局部炎症反应来判定机体是否曾被感染,该方法现常用于检测结核菌(Mycobacterium tuberculosis)和布鲁氏杆菌(Brucella abortus)感染。在DTH小鼠模型的足垫处用钥孔血蓝蛋白、旧结核菌素或卵白蛋白等抗原诱导DTH,一直是药效评价和细胞免疫功能检测的常规方法。目前,T细胞的功能主要通过体外试验进行评价。但是,这些技术的评价结果并不能代表机体整体状态下的细胞免疫状况,因此,人们需要一种更为简便和直观的检测方法。以迟发型变态反应为代表的体内试验被用来估计机体整体的细胞免疫功能时,具有操作性强、检测结果真实的特点。然而,在DTH临床观察中可能由于现象不明显、人为评价误差等原因造成检测结果假阴性和假阳性,并且该方法也无法对细胞免疫功能进行定量分析。
3.2.2 组织器官水平
免疫组织化学技术(immunohistochemistry, IHC)是一种通过组织病理学角度观察组织形态和原位蛋白表达的诊断技术。在非小细胞肺癌的检测中,通过IHC检测PD-1在CD8+T细胞表面的表达对PD-1阻断治疗进行诊断和预测。肿
瘤组织中的标记物可以单独预测,也可以联合预测。然而,传统的 IHC 方法使用单一标记物无法满足反映复杂免疫微环境全部情况的要求。为了满足对技术改进的需求,许多高度多元化的组织成像技术不断发展,能够对细胞组成、功能状态和细胞与细胞之间相互作用进行全面研究,极大地提高了组织样品的利用率。其中,基于酪胺信号放大技术的多重免疫组织化学(multiple immunohistochemistry, mIHC)能够提供多个标记物的分布情况和组织组成的整体视图,很好地解决了 IHC 样品利用率低的问题,有望更清晰地解析疾病的发病机制,从而更深刻地理解癌症的发展。相较于 DTH 临床观察的整体性评估,IHC 的优势在于能够在组织切片上原位定位和定性某种物质的存在及分布状态,甚至可以相对定量地显示其含量。尽管 IHC 能够分析组织内细胞免疫,具有敏感性强、特异性高和定位准确等优点,但在实际应用中,其操作过程复杂,且多个步骤易出现问题,如组织固定时间短、脱水浸蜡不充分、切片过厚或有褶皱、封闭和洗涤过强等,这些问题都会导致结果无法判断。因此,人们需要寻求一种同时具有免疫组化技术优点且操作过程更加简便的检测技术。
3.2.3 免疫细胞水平
正常生理情况下,机体中免疫细胞保持动态稳定。但是,当机体受到刺激后,各类免疫细胞的数量、比例和功能等发生变化。因此,通过对T淋巴细胞及其亚群和自然杀伤细胞(natural killer cell, NK cell)等数量、比例和功能的检测,可以对机体的细胞免疫状态进行评估。
(1) E玫瑰花环(erythrocyte rosettes, E-R)
通过观察T细胞表面E受体与其他种类红细胞结合形成的玫瑰花环,评估机体细胞免疫水平和变化。该试验以玫瑰花环形成率表示T细胞百分比,根据不同成熟程度T细胞的比例反映机体免疫状态。
(2) 四聚体技术(MHC tetramer technology)
将4个MHC分子形成四聚体,与抗原特异性T细胞表面多个T细胞受体(T cell receptor, TCR)结合来定量分析T细胞数量。虽然MHC四聚体技术检
测速度快、灵敏度高、特异性强,但它也存在着一定的缺陷,通过该方法检测的特异性T细胞包含不具有效应功能的CD8 + T细胞,这意味着并不是所有检测出阳性的T细胞都能直接执行杀伤靶细胞的功能。
(3) 流式细胞术(flow cytometry, FCM)
FCM发展迅速,现如今可以在不损伤细胞的情况下,同时检测30种参数并分选出高纯度的目标细胞,主要用于淋巴细胞及其亚群的检测。在慢性淋巴细胞白血病的研究中,FCM可同时对CD3-BV510、CD4-PE、CD8-ECD 等多种抗体标记的不同种类T细胞进行多参数分选以测定记忆T细胞的分化状态。随着 FCM 技术的不断发展,其在对T淋巴细胞胞内细胞因子和结合荧光染料标记测定淋巴细胞杀伤和增殖功能等方面的应用不断增加。
(4) 细胞免疫芯片(cell immune-chip,CIM-Chip)
利用细胞表面抗原与抗体特异性反应的免疫学原理和微型化操作方法,在载体上偶联高密度抗原或抗体来捕获细胞。该技术能够高通量地检测多种细胞的多种表面抗原,获取大量样品信息。不同类型白血病中白细胞的抗原表达情况差异较大,利用高密度的抗体微阵列对48种分化抗原进行验证,检测结果的准确性和稳定性与流式细胞仪基本一致,而同一时期的流式细胞术仅能同时测定 3 种抗原。在微阵列上微孔组成材料和特异性抗体或细胞黏附因子不断优化的同时,还利用激光捕获显微切割技术对捕获细胞内的基因和蛋白质组进行分析,从而完成细胞分选。除了在细胞分选、新药物开发等实验室应用外,CIM-Chip 在检测时对样品处理要求低,适用范围广,可根据检测目的灵活地增加或减少检测内容,检测结果使用普通显微镜即可读取,有着极大的临床应用潜力。然而,细胞的非特异性结合、特异性标志物的选择、对细胞内信息的读取和操作的自动化等是该技术亟待解决的问题,也是CIM-Chip 技术未来发展的趋势。
(5) 形态学观察(morphological observation)
T 淋巴细胞转化为淋巴母细胞的过程中,细胞体积、胞质内容物和核染色质等方面发生巨大变化。形态学观察操作简单、成本低,但受到个人主观性的影响,并且不同种类淋巴细胞的变化不尽相同,即使是同一种细胞,在不同刺激条件下的变化也会有所差异。
(6) 放射性同位素法
经典的3H胸腺嘧啶核苷(3H-thymidine, 3H-TdR)掺入法是在淋巴细胞与有丝分裂原共同孵育后,检测细胞增殖合成 DNA 时摄取的 3H-TdR 放射性核素量,判断淋巴细胞增殖功能。该方法是检测抗原特异性细胞增殖最敏感的方法,但由于放射性同位素具有一定的危险性,实际应用较为有限。
(7) 四甲基偶氮噻唑蓝(methyl thiazolyl tetrazolium, MTT)比色法
利用活细胞线粒体中的琥珀酸脱氢酶能还原噻唑蓝为蓝紫色结晶甲臜的特性对增殖的淋巴细胞进行检测。与放射性核苷酸掺入法相比,该方法能较为准确地反映淋巴细胞体外状态。基于MTT法,使用噻唑蓝衍生物 2,3-二-(2-甲氧基-4-硝基-5-磺苯基)-2H-四氮唑-5-甲酰苯胺[2,3-bis-(2-methoxy-4-nitro-5- sulfophenyl)-2H-tetrazolium-5-carboxanilide, XTT]优化的 XTT 法不但具有MTT法检测迅速、操作简单、灵敏度高的优点,还克服了MTT法中甲臜结晶不易溶解的缺点。进一步优化开发的 WST-8 法相比于前面两种方法,对细胞的毒性更小,试验的重复性更好。
(8) 荧光标记法(fluorescent labeling method, FLM)
羧基荧光素二乙酸盐琥珀酰亚胺酯(carboxyl fluorescein diacetate succinimide ester, CFDA-SE)与细胞内蛋白质共价结合,被水解后发出绿色荧光。当淋巴细胞发生增殖时,胞内的荧光强度在 2 个子代细胞中平均分配。根据这一特征,将其结合 FCM 检测淋巴细胞增殖。这种方法最大的优势是可以进行活体标记,对细胞生理活动基本没有影响,安全性高,并且荧光在体内能够持续数周,稳定性强。
(9) ImmuKnow法
传统的淋巴细胞体外功能检测在标准化和有效性方面存在不足。三磷酸腺苷生物发光法基于淋巴细胞发生增殖时,ATP 合成酶的增加优先于大多数细胞因子的原理,以 ATP 为标记物,结合免疫磁珠和生物荧光等技术,荧光素酶利用 ATP 催化荧光素氧化发光,且在该过程中 ATP 浓度与光的强度成正比。因此,可依据光的强度来快速测定 CD4 +T淋巴细胞活化早期的增殖反应。利用 ATP 的这种反应特性,Cylex公司开发了细胞免疫标准化检测技术 ImmuKnow,临床上用于组织器官移植后排斥反应的监测。
(9) 有限稀释法
提取外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)并进行稀释,体外7−18 d后加入对应靶细胞,通过CTL极限稀释倍数来评估组织器官移植时的组织相容性。在培养过程中添加白细胞介素-2(interleukin-2, IL-2)还可以对CD4+T细胞的功能进行检测。
(10) 51Cr 释放法(51Cr release assay)
使用51Cr 标记靶细胞,CTL 的杀伤作用破坏靶细胞的膜的完整性,根据样品中的放射性强度判定CTL 的杀伤功能。该方法结果准确性好、重复性高,是检测抗原特异性 CTL 功能的金标准。并且,该方法也可以应用在 NK 细胞的细胞毒反应评价。
(12)乳酸脱氢酶释放法(lactate dehydrogenaserelease method, LDH release assay)
LDH是活细胞浆内的一种酶,无法穿过细胞膜。当效应细胞攻击靶细胞后,LDH释放到上清中。LDH活性与靶细胞的死亡数目呈正相关。因此,通过对LDH活性检测来判断效应细胞的细胞毒作用。
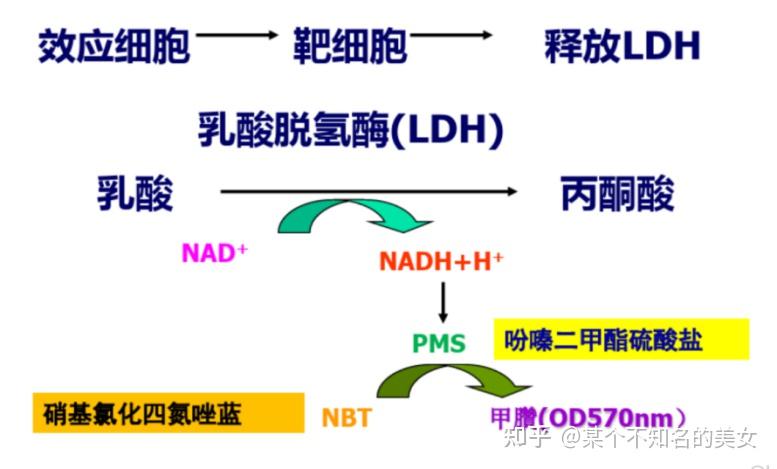
LDH方法原理
LDH方法原理
(13) ELISpot 检测法
ELISpot 是一种高度敏感的检测方法,能够在单细胞水平检测多种细胞因子或细胞毒性物质。其中,干扰素γ(interferon γ, IFN-γ)在细胞中产量较大,很容易被检测出来,也因此成为分析T淋巴细胞和NK细胞功能最常用的细胞因子。ELISpot具有两个明显的优势:除了对功能的定性检测外,还能作为一种定量方法,准确监测治疗效果;在灵敏度方面,ELISpot高于酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)10−200 倍,所以能够对低水平的细胞因子进行检测。
(14)CFC检测法
CFC 利用特定荧光抗体对目标细胞因子染色并进行 FCM 分析。相比于其
他检测方法,CFC 能够避免无法区分不同细胞分泌同种细胞因子的问题,并且可以对淋巴细胞群中不同种细胞进行功能和表型的定量分析,以及对同种细胞中多种细胞因子分泌情况的综合分析。CFC 是研究T细胞应答的一种独特方法,可以同时对机体的 CD4 + T 细胞和 CD8 +T 细胞应答进行检测。但是,由于淋巴细胞群中不同种细胞所需的活化时间不同,CFC不能准确测定抗原特异性细胞产生细胞因子的功能。
3.2.4 免疫分子水平
免疫分子是淋巴细胞发挥功能的重要执行者,反映着淋巴细胞的活化程度。因此,监测细胞因子的谱系变化是判断机体免疫状态的常用方法之一
3.2.4.1 基因水平
通过 PCR、RT-PCR 和实时荧光定量 RT-PCR等方法,能够对细胞因子的 DNA 或 RNA 进行检测,这种基于基因水平上的检测结果具有较高的准确度。
(1) mRNA 定量法
早期有研究人员通过实时荧光定量 RT-PCR 方法对冻存血液中细胞因子的 mRNA 进行分析。在动物实验中,不需要体外刺激和处死动物,mRNA 定量法也可以通过少量样品快速准确地检测出 PBMC 中细胞因子变化。
(2) AlloMap 检测法
通过 20 种特异性免疫分子的基因表达情况,即可判定组织器官移植时排斥反应的严重程度。检测结果在0−40内得分越高,表明排斥反应的风险越高。这种相关性与心内膜心肌活检结果及临床应用结果相吻合,该方法因此成为了监测心脏排斥反应的重要商业化方法。AlloMap 避免了心脏移植时昂贵、具创伤性且结果不稳定的活体检测法,仅通过 PBMC 中相关免疫分子基因表达的差异,即可对中度、重度排斥反应的缺失及心脏移植排斥反应的发生做出有效诊断。
3.2.4.2 蛋白水平检测
尽管细胞因子基因水平的检测方法具有灵敏和迅速等优点,但是体外检测到的 mRNA 水平与实际的蛋白质水平并不总是稳定吻合。因此,细胞因子蛋白水平的直接检测逐渐受到人们的重视。
(1) ELISA 检测法
ELISA 可以对细胞因子直接定量检测,操作简单、检测迅速。但是,ELISA 每次仅能检测一种细胞因子,并且检测的结果是样品中全部数量细胞因子的情况,而不是单个细胞产生细胞因子的情况。因此,利用ELISA 无法通过对细胞因子的检测判定淋巴细胞的数量或单个细胞产生细胞因子的能力。
(2) 液相芯片技术
液相芯片技术是基于多分析物分析(multi-analyte profiling, xMAP)技术的新型生物芯片技术平台。不同于 ELISA 中抗原抗体在固液界面的二维反应模式,液相芯片技术采用的液相环境能使生物分子在三维空间中自由运动并发生结合,克服了固相芯片高通量检测技术的缺陷。液相环境中的主要基质是以红色和橙色各 10 种不同的荧光染料共同标记的、大小约为 5.6 μm 的微球,种类最多可达100 种,并且每个微球能够共价交联 100000 个捕获抗体。这些特点使该技术具有能够最大程度捕获样本中待检分子的高灵敏度、兼具同时检测 100 种分子的高通量和经济性以及自主编辑微球交联抗体的高灵活性。
3.3 吞噬细胞功能
按其形态大小分为两类:小吞噬细胞为中性粒细胞;大吞噬细胞为单核-巨噬细胞系统。
3.3.1 中性粒细胞
3.3.1.1 细胞趋化功能检测
滤膜渗透法( Boyden小室法)
琼脂糖平板法
3.3.1.2 吞噬和杀菌功能检测
显微镜检查法
溶菌法
NBT还原试验
3.3.2 巨噬细胞功能检测
3.3.2.1 碳粒廓清试验
正常小鼠肝中枯否细胞可吞噬清除90%炭粒,脾巨噬细胞约吞噬清除10%炭粒。据此给小鼠定量静脉注射印度墨汁(炭粒悬液)间隔一定时间反复取静脉血,测定血中炭粒的浓度,根据血流中炭粒被廓清的速度,判断巨噬细胞的功能。
3.3.2.2 吞噬功能检测
巨噬细胞对颗粒性抗原物质具有很强的吞噬功能,常用鸡红细胞(CRBC)、白色念珠菌、酵母细胞等作为吞噬颗粒,用斑蟊敷贴法收集人巨噬细胞或从腹腔渗出液获得鼠巨噬细胞。
3.3.2.3 巨噬细胞溶酶体酶的测定
(1)酸性磷酸酶的测定
硝酸铅法
偶氮法
(2)非特异性酯酶的测定
常用a-萘醋酸法
3.3.2.4 细胞毒作用测定
用IFN-γ激活小鼠巨噬细胞,观察其对125I-UdR标记的DBA/2小鼠肥大细胞瘤P815的杀伤活性。
3.3.2.5 巨噬细胞促凝血活性测定
激活的巨噬细胞可产生一-种与膜结合的凝血活性因子,加速正常血浆的凝固,为此取已经37 ℃预温的正常兔血浆和CaCl2混合液,加入经粘附有单层巨噬细胞的试管中,移置37 ℃,即时记录血浆凝固时间。
3.4 NK细胞活性检测
3.4.1 细胞毒性检测
NK细胞的活性可以通过多种方法进行检测,其中最常用的方法是使用细胞毒性检测。测定人NK细胞活性多以K562细胞株作为靶细胞,而测小鼠NK细胞活性则用YAC细胞株,检测方法多种多样。
3.4.1.1 靶细胞直接杀伤法
通过将靶细胞与NK细胞一起培养,观察并计算靶细胞的存活率来评估NK细胞的活性。
具体步骤如下:
(1)将靶细胞和NK细胞分别培养在细胞培养基中。
(2)将培养好的NK细胞与靶细胞按照不同的比例混合。
(3)经过一定时间的培养后,观察并计算靶细胞的存活率,即可评估NK细胞的杀伤活性。
3.4.1.2 溶血变性法
通过观察和测量NK细胞对溶血红细胞的溶血能力来评估NK细胞的活性。
具体步骤如下:
(1)准备一定浓度的溶血红细胞悬液。
(2)将溶血红细胞悬液与NK细胞按照不同的比例混合。
(3)经过一定时间的孵育,离心沉淀红细胞。
(4)通过测量上清液的吸光度来计算溶血率,即可评估NK细胞的杀伤活性。
3.4.2 形态法
将效应细胞与靶细胞按一定比例混合温育,继用台盼蓝或伊红Y等活细胞拒染的染料处理,然后分别计数着染的死细胞和不着染的活细胞,推算NK细胞活性。
3.4.3 酶释放法
将效应细胞与靶细胞按一定比例混合温育,离心沉淀,取上清液检测靶细胞遭破坏后释放出的酶含量。如乳酸脱氢酶(LDH)测定法、MTT比色法。
3.4.4 荧光法
用荧光素标记靶细胞,经与效应细胞共温后,离心去上清,用荧光计检测剩余的活靶细胞的荧光。
3.4.5 核素法
将效应细胞与靶细胞按一定比例混合共温后,离心检测上清液或剩余靶细胞放射性的量,间接反映其活性。方法有靶细胞胞浆释放法和胞核释放法两种。如同位素3H-TdR、51Cr、125I-UdR等方法。
3.4.6 化学发光法
当效应细胞与靶细胞接触时,效应细胞呼吸暴发,生成极不稳定的O2-及OH-,放出光子,在发光剂存在条件下,可被光电倍增管接受和计数,发光量与NK细胞杀伤能力相关。
3.5 细胞因子
细胞因子具有极强的生物学活性,可作为药物用于临床许多疾病的治疗中。细胞因子发挥治疗作用的浓度非常低,治疗指数也比较低,剂量的增加一般都伴随明显的毒副作用。另一方面,细胞因子在体内具有重要的病理作用。在感染、炎症、自身免疫病、AIDS等疾病状态下,有些细胞因子明显增高。通过检测血清或组织液中的细胞因子含量,可以对诊断和治疗作出评价,具有重要的临床意义。根据检测原理和手段的不同,细胞因子的检测技术大致分为三类:免疫学方法、生物学方法和分子生物学方法。
3.5.1 细胞生物学检测法
不同的细胞因子具有不同的生物学活性,选择细胞因子独特的生物学活性,即可检测。
细胞增殖/抑制实验
细胞病变抑制实验
细胞毒实验
细胞趋化实验
3.5.2 免疫学检测法
利用抗体对抗原表位的识别,测定的是可溶性细胞因子的抗原性。
酶联免疫吸附试验ELISA
放射免疫分析RIA
荧光免疫分析法FIA
酶联免疫斑点检测法ELISPOT
3.5.3 分子生物学检测法
利用基因探针,检测特定细胞因子基因表达,即mRNA水平。
斑点杂交
Northern印迹
细胞和组织原位杂交
RT-PCR
3.6 肠道屏障
肠展障功能的评估方法主要包括肠道通透性检测、肠黏膜形态学检查、血浆内毒素水平、血浆D-乳酸含量、血浆内毒素水平等。
3.6.1 肠道通透性检测
肠道通透性测定肠道通 透性(intestinal permeability, IP)是指肠黏膜上皮容易被某些物质分子以非载体或通道介导的被动扩散方式通过的特性,临床上主要指相对于分子量大于150道尔顿的分子物质通过肠黏膜的能力0,而不是离子(如Na+、Cl-等)的渗透。肠黏膜通透性改变可准确反映肠黏膜的损伤程度,是监测肠道屏障功能的重要指标肠黏膜通透性增加,表明肠黏膜完整性被破坏,肠道屏障功能受损。肠道通透性是反映机械屏障最主要的指标,肠道通透性的检测被广泛应用于临床与基础研究中。
3.6.1.1 糖分子探针检测
目前用来检测肠道通透性改变的分子探针主要有糖类、同位素及聚乙二醇类。以非代谢性的低聚糖为探针的肠道通透性检测方法在临床最为常用,其中又以双糖分子乳果糖/甘露醇(Lactulose/ Mannitol ,LM )探针为代表和最常用,尿中I/M比值增高表明肠道通透性增高,黏膜机械屏障功能受损。糖分子探针包括鼠李糖、甘露醇、乳果糖、纤维二糖、葡聚糖等,这些糖在体内无法代谢,并快速经尿排出。由于糖探针在尿液中的浓度比血浆高约100倍,因此易于检测。与其他几种糖分子探针相比,甘露醇和乳果糖回收率较高,受肠腔内渗透压影响较小,是比较理想的两种糖分子探针。其乳果糖/甘露醇排出率比值是目前国际通用的测定肠道通透性的指标。甘露醇是单糖(分子量182,直径0.67nm),分子较小,主要通过肠黏膜细胞膜上的水溶性微孔而吸收。而乳果糖是双糖(分子量342,直径0.92 nm),分子较大,主要通过肠黏膜细胞间的紧密连接而吸收,这也是细菌及其内毒素通过肠黏膜的途径,因此乳果糖的通透性可反映肠黏膜的屏障功能。而且由于乳果糖和甘露醇结构稳定,在体内不代谢,在尿中以原型等量排出,呈游离状态,又无毒性,无免疫原性,因此通过口服这2种双糖,然后测定尿乳果糖与甘露醇吸收比能准确地反映肠黏膜通透性的变化,是一种无创的诊断肠黏膜屏障功能的方法。尿I/M比值增大,说明肠黏膜紧密连接部不完整,通透性增高,肠屏障功能受到损害。近年来,用于测定尿液乳果糖与甘露醇含量的方法有比色法、气相色谱法、液相色谱法、酶法和光谱法等,其中气相和液相色谱法由于其分析快速、准确,已被广泛用于肠道通透性检测。
3.6.1.2 聚乙二醇类探针
在医学临床研究中,利用不同分子量的聚乙二醇类(polyethylene glycol,PE CS),包括PEG-400、PEG-600、PEG-1000、PEG-4000等分别为探针测定急性胰腺炎、肝硬化、炎症性肠病、恶性肿瘤等的研究中,此类探针兼有水溶性和一定的脂溶性,在肠道吸收时易受肠道渗透压的影响,因而限制了其临床应用。测定PEG分子探针的方法均为色谱法。
3.6.1.3 同位素探针
用于肠道通透性测定的同位素探针主要包括5Cr-EDTA、99mTc-DTPA和125I-清蛋白,其优点在于容易检测,但结果易受影响,准确性差,而且这些探针具有放射性,对人体及动物机体有一定的损害,妨碍了其在临床上的应用,目前仅应用于体外或动物实验中。
3.6.2 肠黏膜组织学观察
肠黏膜组织学观察是一种公认的评价肠黏膜屏障功能最常用和最直接的方
法,包括光学显微镜扫描电镜、透视电镜等,其中光学和电子显微镜是观察肠黏膜改变最常用的方法,能够较准确地观察肠黏膜上皮形态结构的变化情况。扫描
电镜常用于观察肠黏膜上皮细胞表面微绒毛的排列情况和柱状上皮细胞内细胞器变化情况。透视电镜则常用于观察肠上皮细胞表面微绒毛排列是否整齐,柱状
上皮细胞结构是否完整,细胞质内细胞器是否异常等。可见,通过光学和电子显微镜等方法可直接观察肠道上皮细胞形态、绒毛结构、排列及细胞内细胞器变化情况,这些指标的变化在一定程度上可反映肠道黏膜机械屏障的损伤,多适用于动物实验研究。
3.6.3 血浆内毒素水平
内毒素(判断细菌是否移位)是革兰氏阴性菌细胞壁中的脂多糖,在细菌代谢过程中或死亡后分解释放,由寡糖支链和类脂A组成,前者为核心多糖,后者是内毒素分子的主要毒性部分,可与机体细胞生物膜上的磷脂相互作用,产生多种生物活性。内毒素主要来源于肠道菌群代谢,正常情况下,生理功能完整的肠黏膜对细菌和内毒素构成屏障作用,内毒素难于进入血液循环。当肠屏障受损导致黏膜通透性增加时,内毒素通过肠黏膜进入机体循环系统,可引起机体一系列生理病理改变。目前检测内毒素的较常用方法是鲎试剂偶氮显色法,具有可定量、重复性好、灵敏度高等优点,但其检测条件要求高,易出现假阴性和假阳性。近来有内毒素测定仪应用于临床,使检测更为方便。
3.6.4 血浆D-乳酸含量
D-乳酸是细菌发酵的代谢产物,肠道多种细菌均可产生,而哺乳动物自身即不产生D-乳酸,也没有代谢D-乳酸的酶类。生理状态下血中D-乳酸主要来源于肠道,且水平较低。当肠道屏障功能受损时,肠道中大量D-乳酸可通过受损的肠黏膜进入血液循环系统,使血浆D-乳酸水平升高。因此,监测血浆中D-乳酸水平可及时反映肠黏膜损害程度和通透性变化。
3.6.5 血浆二胺氧化酶活性
二胺氧化酶(Diamine oxidase, DAO)是人和所有哺乳动物肠黏膜上皮绒毛中具有高度活性的细胞内酶,以小肠活性最高,在其它组织或细胞中几乎不存在,生理状态下血浆中DAO活性很低,因此DAO活性能反映肠上皮细胞成熟度和完整性,是显示肠黏膜屏障功能状态的敏感性指标。当肠黏膜细胞受损,黏膜屏障结构破坏时,肠上皮释放DAO大量入血,或随坏死脱落的肠黏时,肠上皮释放DAO大量入血,或随坏死脱落的肠黏膜细胞进入肠腔内,导致血浆和肠腔DAO活性增高而膜细胞进入肠腔内。因此在临床和实验动物研究中,通过测定血和黏膜组织中DAO活性变化,反映肠道的黏膜屏障,尤其在无创情况下测定血浆DAO活性能更直接地反映肠上皮细胞及肠黏膜屏障结构的损伤程度,是监测肠道屏障功能的重要指标。
目前DAO的测定方法主要包括:
(1)14C(3H)腐胺测定法,是一种放射性的测定方法,有较高的灵敏度;
(2)分光光度法,是国内应用最多的一种方法,具有简便、经济、快速、结果稳定、重复性好的特点;
(3)夹心ELISA法,用免疫组织化学方法检测血DAO含量,具有灵敏、简便、易推广应用的特点。
原文地址:https://zhuanlan.zhihu.com/p/696770225 |
|
 /3
/3 